Cours de physique-chimie | première spécialité
Ce cours correspond à la partie “De la structure des entités à la cohésion et à la solubilité/miscibilité d’espèces chimiques” du programme de première spécialité.
Il est situé dans la partie du programme “Constitution et transformations de la matière – De la structure des entités aux propriétés physiques de la matière”
Cohésion de la matière à l’état solide
- Cohésion d’un solide ionique
- Interaction de van der Waals entre molécules polaires
- Interaction de van der Waals entre molécules apolaires
- Pont hydrogène
- Comparaison des interactions entre entités chimiques
Dissolution d’un composé ionique
- Comment l’eau dissout-elle un composé ionique ?
- Equation de dissolution d’un composé ionique
- Méthode pour écrire l’équation de dissolution d’un composé ionique à partir de sa formule chimique
- Exemples d’équations de dissolution
- Calculer la concentration des ions dissous
- Miscibilité de liquides
- Solubilité d’une espèce chimique dans un solvant
- Méthode d’extraction liquide-liquide
Hydrophilie, lipophilie et amphiphilie d’une espèce organique
REVISER – AUTRES COURS DE PREMIERE SPECIALITE – APPROFONDIR ET DECOUVRIR
Cohésion de la matière à l’état solide
Par définition l’état solide est un état compact et ordonné où les entités chimiques sont fixes les unes par rapport aux autres. Ces entités sont maintenues à leur place par les forces qu’exercent les entités chimiques voisines. Dans chaque solide il s’exerce donc des forces (en général de nature électrique) entre les entités chimiques qui permettent d’aboutir à la cohésion.
Les forces qui s’exercent entre les entités chimiques d’un solide peuvent varier suivant la nature et les propriétés de ces entités ( ions, molécules polaires, apolaires…)
Cohésion d’un solide ionique
Un solide ionique est constitué d’ions mais il est toujours globalement neutre: il combine toujours des cations et des anions en des proportions qui permettent aux charges positives de compenser les charges négatives.
Les anions sont par définitions des ions négatifs et portent globalement une ou plusieurs charges élémentaires négatives.
Les cations sont des ions positifs qui portent globalement une ou plusieurs charge élémentaires positives.
Dans un solide ionique les cations sont essentiellement entourés d’anions tandis que les anions sont essentiellement entourés de cation.
Par conséquent il s’exerce principalement des forces électriques attractives:
- les ions positifs attirent vers eux les ions négatifs voisins
- les ions négatifs attirent vers eux les ions positifs voisins.
Exemple: cohérence du chlorure de sodium
Le chlorure de sodium, de formule chimique NaCl est constitué de cations sodium (Na+) et d’anions chlorure (Cl–) en des proportions identiques (il y a autant de cations sodium que d’anions chlorure).
Les plus proches voisins d’un cation sodium sont des anions chloure et inversement les plus proches voisins d’un anion chlorure sont des cations sodium.
Les forces électriques attractives qui s’exercent entre des charges de signes opposées (cations et anions) sont donc globalement plus intenses que les forces électriques répulsives qui s’exercent entre des charges de même signe (entre cations et entre anions).
La force électrique (force de Coulomb) maintient donc ensemble cations et anions et assure la cohésion de ce solide ionique.
Voir aussi cours “La liaison ionique“
Interaction de Van der Waals entre molécules polaires
Les molécules sont des entités chimiques globalement neutres cependant les molécules polaires disposent d’un pôle positif et d’un pôle négatif.
Les pôles d’une molécule polaire peuvent donc exercer une force électrique sur les pôles des autres molécules.
Dans un solide les molécules sont orientées naturellement de manière à ce que:
- le pôle positif d’une molécule soit proche du pôle négatif des molécules voisines.
- Le pôle négatif d’une molécule soit proche du pôle positif des molécules voisines.
En raison de cette orientation il s’exerce des forces électriques attractives entre les molécules: les pôles négatifs attirent les pôles positifs.
Les forces électriques qui s’exercent entre des molécules polaires sont appelées forces ou interactions de van der Waal (en hommage au physicien Johannes Diderik van der Waals)
Les interactions de van der Waals sont moins intenses que les forces électriques qui s’exercent entre des ions car les pôles positifs et négatifs des molécules polaires ne portent qu’une fraction de charge élémentaire alors que les ions en possède une entière voire plusieurs.
En résumé:
Il existe entre les pôles des molécules polaires une interaction attractive de nature électrique appelée interaction (ou liaison) de van der Waals. Il s’agit d’interactions intermoléculaires (qui s’exercent entre molécules) à l’origine de la cohésion des solides constitués de molécules polaires.
Exemples
L’interaction de van der Waals entre molécules polaires existe:
- entre deux molécules d’eau (qui sont polaires)
- entre deux molécule d’éthanol (qui sont polaires)
- entre une molécule d’eau et une molécule d’éthanol
Voir aussi cours “Les liaisons de Van der Waals
Interaction de van der Waals entre molécules apolaires
Les molécules apolaires peuvent exercer entre elles des interactions attractives qui sont aussi appelées interactions (ou liaisons) de van der Waals.
Par définition les molécules apolaires ne disposent pas de centres positifs et négatifs permanents cependant chaque atome d’une molécule apolaire peut être le siège d’une polarisation temporaire.
En effet la répartition des électrons négatifs autour du noyau positif d’un atome n’est pas en permanence rigoureusement symétrique et il en résulte que la plupart du temps le centre de ces électrons est légérement décalé par rapport au noyau:
Un atome possède une polarisation variable car le centre négatif ne coïncide pas en permanence avec le noyau qui est le centre des charges électriques positives, le centre négatif possède une localisation qui évolue au cours du temps en raison du mouvement des électrons
Le pôle positif d’un atome (son noyau) ainsi que le pôle négatif de cet atome (centre du cortège électronique) peuvent exercer des interactions attractives avec les pôles des atomes des autres molécules.
Les atomes d’une même molécule on tendance à s’influencer mutuellement et leurs polarisations on tendance à se cumuler par conséquent:
Plus la taille d’une molécule est importante (plus le nombre d’atomes est élevé) et plus l’interaction de van der Waals entre molécules apolaires est intense.
Exemples
- L’interaction de van der Waals entre molécules apolaires existe:
- entre des molécules de cyclohexane
- entre des molécules d’octane
- entre des molécules d’octane
- entre des molécules de dioxyde de carbone

Voir aussi cours “Les liaisons de Van der Waals“
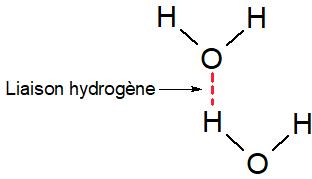
Le pont hydrogène
Qu’est-ce qu’un pont hydrogène ?
Le pont hydrogène, aussi appelé liaison hydrogène, est une interaction intermoléculaire qui s’exerce entre:
- un atome d’hydrogène lié à un atome nettement plus électronégatif que lui (l’oxygène, l’azote, le chlore…)
- et un atome électronégatif portant au moins un doublet non liant (l’oxygène, le chlore, l’azote…)
Quelle est la particularité du pont hydrogène par rapport aux interactions de van der Walls classiques ?
Le pont hydrogène correspond à une interaction plus intense que l’interaction de van der Waals classique car la polarisation de la liaison entre l’hydrogène et l’atome électronégatif décale l’unique électron de l’hydrogène vers cet atome et laisse “à nu” son noyau qui constitue son pôle positif.
Par conséquent le centre positif constitué par le noyau est facilement “accessible” car il n’est “protégé” par aucun électron (l’unique électron est décalé vers l’atome électronégatif de la liaison). Il peut s’ approcher facilement des centres négatifs constitués par les doublets non liants des atomes électronégatifs. La proximité ainsi rendu possible entre deux pôles permet à la force électrique attractive d’atteindre des valeurs plus élevées.
Quels facteurs peuvent influencer le pont hydrogène ?
Le pont hydrogène est une interaction intermoléculaire attractive d’autant plus intense que:
- L’atome lié à l’hydrogène est électronégatif
- L’atome avec lequel interagit l’hydrogène est électronégatif
Voir aussi cours “La liaison hydrogène“
Comparaison des interactions entre entités chimiques
Les différentes interactions entre entités chimiques ne s’exercent pas toutes avec la même intensité. Si on les range par ordre décroissant d’intensité on obtient le classement suivant:
C’est à dire que l’interaction entre ions est plus intense que l’interaction par pont hydrogène qui est elle-même plus intense que l’interaction entre molécules polaires qui est elle-même plus intense que l’interaction entre molécules apolaires.
Dissolution d’un composé ionique
Comment l’eau dissout-elle un composé ionique ?
Les molécules d’eau sont des entités polaires, dont les pôles peuvent interagir avec les cations et anions qui constituent un solide ionique.
Au contact de l’eau un solide ionique peut se dissocier:
- l’interaction attractive exercée par le pôle négatif des molécules d’eau (situé sur l’oxygène) peut “arracher” les cations situés en surface du solide ionique.
- l’interaction attractive exercée par le pôle positif des molécules l’eau (situé entre les deux hydrogène) peut “arracher” les anions situés en surface du solide ionique.
L’eau est susceptible de dissocier un solide ionique, c’est à dire de séparer les ions qui le constituent.
Après dissociation les ions sont “solvatés”, c’est à dire que:
- chaque cation (positif) s’entoure de molécules d’eau dont le pôle négatif pointe vers lui.
- chaque anion (négatif) s’entoure de molécules d’eau dont le pôle positif pointe vers lui.
Après dissociation les ions sont solvatés, c’est à dire qu’ils s’entourent de molécules d’eau. Les cations attirent les pôles négatifs des molécules d’eau tandis que les anions attirent les pôles positifs.
Equation de dissolution d’un composé ionique
La dissolution d’un composé ionique dans l’eau peut être modélisée par une équation de dissolution qui comporte:
- à gauche la formule du composé ionique.
- à droite les formules des ions dissociés.
- au centre une flèche orientée vers la droite
- les coefficients stoechiométriques traduisant la conservation des éléments chimiques et de la charge électrique
- la notation de l’état des différentes espèces chimiques La formule du composé ionique est suivi de la mention (s) s’il s’agit d’un solide. La formules des ions formés est suivi de la mention (aq) qui signifie qu’ils sont dissous en solution aqueuse.
Voir aussi cours “Equation de dissolution d’une espèce chimique en solution”
Méthode pour écrire l’équation de dissolution d’un composé ionique à partir de sa formule chimique
Cette méthode sera illustrée par l’exemple de l’écriture de l’équation de dissolution du sulfure d’aluminium.
Etape 1: Déterminer ou trouver la formule chimique du solide ionique.
La plupart du temps cette formule est donnée dans l’énoncé des exercices cependant il est parfois possible de la retrouver.
Dans le cas du sulfure d’aluminium la formule chimique est Al2S3. Il est possible de retrouver cette formule en considérant que ce composé est la combinaison d’ions aluminium et d’ions sulfure (ion soufre), puis en déterminant la formule de ces ions monoatomiques en appliquant les règles de stabilités. Ces dernières permettent de prévoir que l’ion stable de l’aluminium est Al3+ et que celui du soufre est S2-. Enfin la neutralité électrique du composé ionique impose une proportion de deux ions Al3+ (de charge totale 2 x 3+ = 6+) pour trois ions sulfure ( de charge totale 3 x 2+ = 6+) soit la formule déjà donnée Al2S3.
Etape 2: Déterminer ou trouver la formule des ions formés.
La formule de ces ions est parfois fournie, dans le cas d’ions monoatomiques il est possible d’exploiter les règles de stabilité pour retrouver ces formules. Il est aussi parfois possible d’exploiter la formule déjà connue d’un des ions ainsi que la neutralité électrique du composé ionique pour déterminer la formule de l’ion manquant.
Dans le cas du sulfure d’aluminium on peut déterminer que l’atome d’aluminium de configuration électronique 1s22s22p63s23p1 perd les trois électrons de sa couche n°3 et forme le cation aluminium Al3+. Le soufre possède quant à lui une configuration 1s22s22p63s23p4 , il gagne deux électrons pour compléter sa couche n°3 et forme l’ion S2-.
Etape 3: Ecrire l’équation de dissolution non équilibrée en indiquant seulement la formule du composé ionique et celle des ions formés
Exemple: Al2S3→ Al3+ + S2-
Etape 4: ajouté la mention (s) pour le solide ionique et (aq) pour les ions dissous en solution aqueuse.
Exemple: Al2S3(s)→ Al3+(aq) + S2-(aq)
Etape 5: ajouter les coefficients stoéchiométriques des ions pour obtenir l’équation de dissolution finale équilibrée.
L’équilibrage peut se faire rapidement et sans hésitation puisque chaque ion a même coefficient stoechiométrique que son indice dans la formule du composé ionique.
Dans le suflate d’aluminium Al2S3 l’aluminium a pour indice “2” et donc son coefficient stoechiométrique est donc aussi “2”
Le soufre a comme indice “3” donc son coefficient stoechiométrique est aussi “3” dans l’équation.
On obtient donc l’équation de dissolution du sulfate d’aluminium:
Al2S3(s)→ 2Al3+(aq) + 3S2-(aq)
Voir aussi cours “Equation de dissolution d’une espèce chimique en solution“
Exemples d’équations de dissolutions
- Equation de dissolution du chlorure de sodium:
NaCl(s) → Na+(aq) + Cl–(aq)
Cette équation indique que le chlorure de sodium est un solide de formule NaCl et qui se dissout en formant un ion sodium Na+ et un ion chlorure Cl–
- Equation de dissolution du chlorure d’aluminium:
AlCl3(s) → Al3+(aq) + 3Cl–(aq)
D’après cette équation le chlorure d’aluminium solide de formule se dissocie et se dissout en formant un ion Aluminium Al3+ pour trois ions chlorure Cl–
- Equation de dissolution du sulfate d’aluminium:
Al2(SO4)3(s) → 2Al3+(aq) + 3SO42-(aq)
La dissolution du sulfate d’aluminium solide Al2(SO4)3 conduit à la formation de deux ions aluminium Al3+ pour trois ions sulfate SO42-
Voir aussi cours “Equation de dissolution d’une espèce chimique en solution“
Calculer la concentration des ions dissous
Il est possible de déterminer la concentrations des ions issus de la dissociation d’un composé ionique à partir:
- de la concentration du composé ionique
- de l’équation de dissolution
Il existe un rapport de proportionnalité entre la concentration d’un ion et la concentration du composé ionique dont il est issu:
le coefficient de proportionnalité entre la concentration de l’ion et celle du composé ionique correspond au coefficient stoechiométrique de l’ion dans l’équation de dissolution.
Remarque
Les proportions entre les concentrations correspond aussi aux proportions entre quantités de matière.
Exemples
Dissolution du chlorure de sodium
L’équation de dissolution est NaCl(s) → Na+(aq) + Cl–(aq)
Dans cette équation toutes les espèces chimiques ont le même coefficient stoechiométrique (l’absence de coefficient équivaut à un coefficient “1”) par conséquent elles ont toutes la même concentration : C(Na+) = C(Cl–) = C(NaCl)
Dissolution du chlorure d’aluminium
Son équation de dissolution est AlCl3(s) → Al3+(aq) + 3Cl–(aq)
D’après cette équation:
- La concentration en ion aluminium est égale à celle du chlorure d’aluminium C(Al3+) = C(AlCl3)
- La concentration en ion chlorure correspond à trois fois celle du chlorure d’aluminium C(Cl–) = 3 x C(AlCl3)
- La concentration en ion chlorure est égale à trois fois celle de l’ion aluminium C(Cl–) = 3 x C(AlCl3)
Dissolution du sulfure d’aluminium
Elle peut être décrite par l’équation de dissolution Al2S3(s) → 2Al3+(aq) + 3S2-(aq)
D’après cette équation:
- La concentration en ion aluminium Al3+ correspond à deux fois celle du sulfure d’aluminium C(Al3+) = 2 x C(Al2S3)
- La concentration en ion sulfure S2- correspond à trois fois celle du sulfure d’aluminium C(S2-) = 3 x C(Al2S3)
Solubilité et extraction
Miscibilité de liquides
Au niveau microscopique cela signifie que les molécules des deux liquides se dispersent les unes parmi les autres: les molécules du premier liquide se dispersent parmi les molécules du deuxième liquide et réciproquement.
Pour que ce brassage de molécules soit possible il doit exister des interactions intermoléculaires attractives d’une intensité comparable au sein du premier liquide et du deuxième.
Si les entités chimiques du premier liquide (entités 1) exercent entre elles des interactions nettement plus fortes que les entités du deuxième liquide (entités 2) alors les entités 1 s’entourent d’autres entités 1 et les entités 2 ne peuvent se disperser parmi les entités 1: il se forme deux phases distinctes qui constituent un mélange hétérogène, les liquides ne sont pas miscibles.
Si au contraire les entités chimiques des deux liquides exercent entre elles des interactions d’une intensité comparable alors elles attireront vers elles indifféremment les entités du premier ou du deuxième liquide: il ne se forme qu’une seule phase où se mèlent les différentes sortes de molécules, les deux liquides sont miscibles.
Par conséquent, pour que deux liquides soient miscibles, ils doivent être constitués d’espèces chimiques dont la polarité est comparable:
Des liquides constitués de molécules polaires ne sont miscibles qu’avec des liquides constitués aussi de molécules polaires et des liquides constitués de molécules apolaires ne sont miscibles qu’avec des liquides constitués de molécules apolaires ou très peu polaires.
Par exemple, l’eau (polaire) est miscible avec l’éthanol (apolaire)
Des liquide composés de molécules polaires ne sont pas miscibles avec des liquides constitués de molécules apolaires
Par exemple l’eau (polaire) n’est pas miscible avec le cyclohexane (apolaire)
En résumé:
Solubilité d’une espèce chimique dans un solvant
Le mécanisme de dissolution d’un solide ionique dans de l’eau a déjà été décrit dans le paragraphe précédent “Comment l’eau dissout-elle un composé ionique ?”
D’une manière générale la dissolution d’une solide (ionique ou moléculaire)se réalise en deux étapes:
- Les entités chimiques du solide se “séparent” de leurs voisines sous l’effet du liquide.
- Les entités chimiques libérées par le solide se dispersent parmi les molécules du liquide et s’entourent de ces dernières.
Pour qu’un solide soit soluble dans un liquide, c’est à dire pour qu’il puisse s’y dissoudre, il est nécessaire que:
- les molécules du liquide puissent exercer une attraction suffisante pour vaincre les interactions attractives qui maintiennent les entités du solide ensemble.
- L’interaction attractive entre une molécule de liquide et une entité provenant du solide soit assez forte pour que chaque molécule de liquide ne s’entoure pas seulement d’autres molécules de liquide mais aussi d’entités du solide (c’est une condition indispensable pour que les entités du solide puissent se disperser dans le liquide).
De ces contraintes il résulte que:
En général la solubilité augmente avec polarité du solvant.
Voir cours ” Solubilité d’une espèce chimique “
Méthode d’extraction liquide-liquide
Cette méthode, aussi appelée méthode d’extraction par solvant, permet d’extraire une espèce chimique d’une solution en exploitant sa différence de solubilité dans différents solvants.
Pour qu’une extraction liquide-liquide soit possible il faut choisir un solvant vérifiant deux critères:
- il doit être non miscible avec le solvant de la solution
- la solubilité de l’espèce chimique à extraire doit y être supérieure à celle du solvant de la solution
L’extration liquide-liquide se fait dans une ampoule à décanter, on y mélange la solution et le solvant extracteur.
L’agitation permet de mettre en contact la solution avec le solvant, l’espèce chimique à extraire va passer en grande partie dans ce nouveau solvant où elle est davantage soluble.
Voir cours “L’extraction par solvant“
Hydrophilie, lipophilie et amphiphilie d’une espèce organique
Espèce chimique hydrophile
Le terme hydrophile signifie “qui aime l’eau”.
Une espèce chimique est dite hydrophile si elle présente une affinité pour l’eau et si elle peut si dissoudre.
Le caractère hydrophile d’une espèce chimique dépend de sa capacité à exercer des interactions attractives avec les molécules d’eau, une espèce chimique peut donc etre hydrophile si:
Une espèce chimique pourra donc avoir un caractère hydrophile si elle comporte des groupes fonctionnels susceptibles de la rendre polaire et/ou d’établir des ponts hydrogène avec l’eau.
Les molécules organiques qui présente un caractère hydrophile possèdent en général l’un des groupes fonctionnels suivant:
- hydroxyle
- carbonyle
- carboxyle
- amine
Espèce chimique lipophile
Le terme “lipophile” signifie “qui aime la graisse”
Les graisses, l’huile sont de molécules à longues chaine carbonées pas ou très peu polaires.
Une espèce chimique lipophile est une espèce présentant une affinité pour les milieux apolaires (comme l’huile) qui est elle-même apolaire ou très peu polaire.
Elles sont principalement constituées de longues chaînes carbonées et ne présente pas (ou très peu) de groupes fonctionnels.
Remarque
Une espèce chimique lipophile est aussi qualifiée d’hydrophobe.
Espèce chimique amphiphile
Une espèce chimique est dite amphiphile si une partie de cette espèce présente un caractère hydrophile tandis que l’autre présente un caractère lipophile.
Une espèce amphiphile possède donc un partie apolaire (correspondant souvent à une chaîne carbonée sans groupe fonctionnel et une partie qui est soit polaire soit ionique.
Exemple de substance amphiphile: le savon
Les espèces chimiques qui constituent le savon sont des carboxylates de sodium qui en présence d’eau forment des anion carboxylates.
Ces espèces chimiques présentent donc un caractère amphiphile.
La partie lipophile a tendance à se fixer dans les goutelette d’huile ou de corps gras tandis que la partie hydrophobe reste au contact de l’eau.
Si une eau savonneuse rentre en contact avec de l’huile ou un corps gras il se forme alors des micelles:
ce sont des gouttelettes de corps gras dans lesquelles se sont fixées les parties lipophiles des ions carboxylate. Elles sont hérissées groupes carboxylate hydrophiles qui la rendent soluble dans l’eau.
Le savon permet donc d’éliminer les corps gras grâce à au caractère amphiphile de ses constituants qui les recouvrent de
Remarque
Dire que les graisses deviennent solubles dans l’eau grâce au savon est une simplification, en réalité il se forme une émulsion stable.
A réviser
Cours de seconde:
- Corps purs et mélanges au quotidien
- Mélanges d’espèces chimiques
- Mélanges homogènes et hétérogènes
- Les solutions aqueuses, un exemple de mélange
- Du macroscopique au microscopique, de l’espèce chimique à l’entité
- Les entités chimiques
- La neutralité électrique de la matière
- Les composés ioniques
- La charge électrique
- Les doublets liants
- Les doublets non liants
- L’état solide
Les autres cours de première spécialité
- Quantité de matière, masse molaire et concentration
- Réaction d’oxydoréduction et avancement
- Titrage colorimétrique redox
- Schéma de Lewis, géométrie, électronégativité et polarisation
- Cohésion des solides, dissolution, solubilité, hydrophilie et lipophilie
- Structure et nomenclature des espèces organiques
- Synthèse organique
