Cours de physique-chimie | première spécialité
Ce cours correspond à la partie “Synthèses d’espèces chimiques organiques” du programme de première spécialité.
Il est situé dans la partie du programme “Constitution et transformations de la matière – Propriétés physico-chimiques, synthèses et combustions d’espèces chimiques organiques”
Protocole d’une synthèse organique
- Qu’est-ce qu’une synthèse organique ?
- Qu’est-ce qu’un protocole ?
- Les principales étapes d’une synthèse organique
- Préparation des réactifs
- Transformation des réactifs
- Le chauffage à reflux
- Isolement et purification du produit de la synthèse
- Analyse et caractérisation du produit
- Qu’est-ce que le rendement d’une synthèse ?
- Notation et unité
- Calculer le rendement d’une synthèse
- Valeur du rendement
- Calculer un rendement à partir des masses de produit
- Calculer un rendement à partir des volumes de produit
- Comment expliquer que le rendement d’une synthèse soit faible ?
REVISER – AUTRES COURS DE PREMIERE SPECIALITE – APPROFONDIR ET DECOUVRIR
Protocole d’une synthèse organique
Qu’est-ce qu’une synthèse organique ?
La synthèse chimique a déjà été abordée en seconde (voir cours de seconde sur les transformations chimiques ).
Pour rappel une synthèse correspond à un ensemble d’opérations incluant au moins une transformation chimique qui permet de produire une espèce chimique.
Une synthèse est dite organique si l’espèce chimique qu’elle a pour objectif de produire est organique.
Qu’est-ce qu’un protocole ?
Le protocole décrit l’ensemble des opérations à effectuer pour réaliser une synthèse.
Il précise:
- Les réactifs et leurs quantités
- La verrerie (bécher, pipette…) à utiliser en précisant la contenance des différents récipients
- Le matériel (accessoire, appareil…)
- Les conditions physiques dans lesquelles la ou les transformations chimiques doivent avoir lieu (température, pression…)
- Eventuellement la durée des différentes opérations (chauffage, séchage …)
Les principales étapes d’une synthèse organique
Les principales étapes que comprend une synthèse organique sont les suivantes:
- Préparation des réactifs Pesée ou mesure du volume de chaque réactif.
- Transformation des réactifs Les réactifs sont mis en présence dans des conditions qui favorisent la transformation chimique.
- Isolement et purification du produit de la synthèse L’espèce chimique synthétisée est extraite du milieu réactionnel en essayant d’éliminer les autres espèces chimiques présentes.
- Analyse et caractérisation du produit On essaye de vérifier par des tests physiques ou chimiques que l’espèce chimique isolée est bien celle que l’on souhaitait obtenir.
Préparation des réactifs
Pour chaque réactif qui intervient dans la transformation chimique il faut prélever la quantité prévue par le protocole.
- Pour un réactif solide (souvent sous forme de poudre) on réalise une pesée. On utilise donc une balance (d’une précision suffisante), une spatule et un sabot de pesée (ou une coupelle).
- Pour un réactif liquide on mesure le volume. Pour le maximum de précision la mesure de volume se fait avec une pipette jaugée ou une pipette graduée. Le matériel utilisé est donc une pipette (jaugée ou graduée) et une propipette.
Lors de cette étape on peut aussi préparer le solvant. Son volume ne nécessite en général pas d’être mesuré avec une précision maximale et l’on peut se contenter de le mesurer avec une éprouvette graduée.
Que faire si le protocole ne précise pas les quantités de réactif à utiliser ?
Dans ce cas les quantités de réactif sont à déterminer:
- En fonction de la quantité de produit que l’on souhaite synthétiser.
- En utilisant le tableau d’avancement pour trouver l’avancement maximal et la quantité initiale de chaque réactif. (voir cours sur le tableau d’avancement )
- Eventuellement en mettant en excès un réactif qui facilite l’extraction et la purification de l’espèce chimique synthétisée.
Comment déterminer la masse d’un réactif à partir de sa quantité de matière ?
Si le protocole précise la quantité de matière d’un réactif solide mais pas sa masse alors cette dernière peut se calculer grâce à la relation:
m = n x M
où:
- n est la quantité de matière en mole (mol)
- M est la masse molaire du réactif en gramme par mol (g.mol-1), elle peut facilement être calculée à partir de la formule brute (voir cour de première Quantité de matière, masse molaire et concentration )
- m est la masse de réactif recherchée
Comment déterminer le volume d’un réactif liquide à partir de sa quantité de matière ?
Si le protocole indique la quantité de matière d’un réactif liquide au lieu de préciser son volume alors ce dernier peut être calculé:
- En déterminant d’abord sa masse “m” grâce à la relation m = n x M (voir paragraphe précédent)
- En calculant ensuite le volume à partir de la masse et la masse volumique grâce à la relation
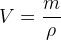 où m est la masse en gramme (g), ρ est la masse volumique en gramme par litre (g.L-1) et V est le volume de liquide recherché en litre (L)
où m est la masse en gramme (g), ρ est la masse volumique en gramme par litre (g.L-1) et V est le volume de liquide recherché en litre (L)
Transformation des réactifs
Pour que la transformation chimique puisse avoir lieu dans les meilleures conditions il faut:
- Réunir les réactifs dans un récipient adapté (souvent un ballon)
- Placer le milieu réactionnel dans les conditions physiques optimales (on chauffe pour élever la température)
- Favoriser le contact entre réactifs (agiter)
- Limiter les pertes de réactifs et de produits en particulier pendant le chauffage (utiliser un reflux à eau ou à air)
- Respecter les consignes de sécurité
Le chauffage à reflux
- Pourquoi chauffer le milieu réactionnel ?
Certaines transformations chimiques comme les réactions de précipitation ou de combustion sont rapides mais la plupart des transformations intervenant dans une synthèse organique sont lentes: la consommation totale des réactifs (ou éventuellement celle du réactif limitant) peut prendre plusieurs minutes à plusieurs heures.
Pour accélérer ces transformations chimiques (augmenter ce qu’on appelle la “vitesse de réaction”) on peut chauffer le mélange réactionnel car dans la majorité des cas les transformations chimiques sont d’autant plus rapides que la température est élevée.
Chauffer le milieu réactionnel permet d’accélérer la réaction de synthèse.
- Les inconvénients d’un chauffage simple
Chauffer le mélange réactionnel va favoriser la vaporisation des espèces chimiques: une partie des réactifs , des produits et du solvant peut être libérée sous forme gazeuse dans l’air.
Un chauffage simple risque donc de conduire à une perte de matière:
- la quantité de produit synthétisée sera plus faible
- les vapeurs libérées peuvent constituer un danger pour la santé
- Le principe du chauffage à reflux
La libération des vapeurs ne peut être empêchée simplement en chauffant un récipient fermé: la pression y augmenterait avec la température et il y aurait risque d’explosion.
Lors d’un chauffage à reflux le milieu réactionnel est toujours soumis à la même pression (la pression atmosphérique) mais les vapeurs issues du milieu réactionnel chauffé s’élèvent dans un réfrigérant aux parois froides qui provoquent leur liquéfaction. Les gouttes de liquide qui se forment sur les parois du réfrigérant finissent par retomber dans le milieu réactionnel: il y a reflux !
Le chauffage à reflux est un système de chauffage qui fait intervenir un réfrigérant grâce auquel les vapeurs de réactif, de produit et de solvant ne sont plus libérées dans l’air mais sont liquéfiées et réintègrent le milieu réactionnel.
Le chauffage à reflux se fait le plus souvent avec un réfrigérant à eau mais peu aussi parfois se faire avec un réfrigérant à air.
- Chauffage à reflux avec réfrigérant à eau
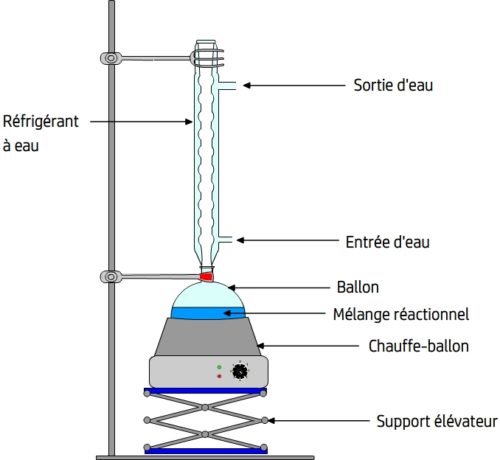
Le montage comprend les éléments suivant:
La potence: elle permet de suspendre de manière stable le ballon et le réfrigérant.
Le ballon: les réactifs y sont réunis, il permet un chauffer le milieu réactionnel de manière plus homogène qu’un récipient à fond plat (comme un erlenmeyer).
Le chauffe-ballon: c’est le système de chauffage adapté au ballon.
Le support élévateur (aussi appelé support-boy): il soutient le chauffe-ballon en permettant d’une part d’ajuster sa hauteur pour un contact optimal avec le ballon et d’autre part il peut être abaissé afin de supprimer ce contact et de couper rapidement le chauffage du ballon en cas d’urgence.
Le réfrigérant à eau: il est fixé à la potence grâce à des pinces et adapté au ballon. Il comporte un “conduit intérieur” qui fait communiquer le ballon avec l’air afin de maintenir une pression proche de la pression atmosphérique. Ses parois sont creuses et parcourues par un courant d’eau froide qui est obtenu en reliant l’entrée d’eau (en bas) à un robinet délivrant de l’eau froide tandis que l’eau est évacuée par la sortie d’eau (en haut) et déversée dans un évier.
- Chauffage à reflux avec réfrigérant à air
C’est un dispositif plus simple à mettre en oeuvre et nécessitant moins de matériel que le chauffage à reflux avec réfrigérant à eau.
Il peut être utilisé dans le cas où la synthèse se fait avec un chauffage modéré (au bain marie par exemple), ne nécessitant pas d’atteindre l’ébullition et avec des espèces chimiques peu volatiles (dont la température d’ébullition est nettement supérieure à celle où le mélange réactionnel est chauffé).
Dans ce cas le fluide réfrigérant est simplement l’air ambiant.
Le récipient contenant le milieu réactionnel (souvent un erlenmeyer) est fermé par un bouchon à un trou sur lequel on adapte un tube en verre (qui en général est simplement une pipette en verre).
Ce tube en verre est refroidi par l’air ambiant et permet de provoquer la liquéfaction des vapeurs qui pourraient se dégager du milieu réactionnel.
Isolement et purification du produit de la synthèse
Lorsqu’on synthétise une espèce chimique celle-ci se trouve mélangée aux autres espèces du système chimique: les réactifs non consommés, le solvant, les autres produits….
Il est donc nécessaire de l’extraire (l’isoler) et de retirer toute trace d’autres espèces chimiques (la purifier)
Les techniques à mettre en oeuvre pour isoler et purifier cette espèce dépendent de son état physique, de ses propriétés chimiques et des propriétés des espèces chimiques dont elle doit être séparée.
- La filtration:
Elle peut être utilisée pour isoler un produit solide insoluble dans le milieu réactionnel qui se présente sous forme de particules solides.
Voir fiche de cours “Filtration”
- L’extraction liquide-liquide (aussi appelée extraction par solvant):
Elle peut être utilisée dans le cas d’un produit solide soluble dans le milieu réactionnel.
Voir fiche de cours “Extraction par solvant”
- L’ampoule à décanter:
On peut l’utiliser pour séparer une espèce organique liquide non miscibles avec l’autre phase du milieu réactionnel.
- La distillation:
Elle peut être utilisée pour isoler une espèce chimique liquide miscible à condition que l’écart entre sa température d’ébullition et celle des autres espèces chimiques du mélange soit suffisant (au moins un dizaine de degré).
Analyse et caractérisation du produit
Une fois que le produit de synthétisé est isolé et purifié il est nécessaire de vérifier qu’il correspond bien à l’espèce chimique que la synthèse était censée aboutir.
Pour cela on fait appel à des tests et des méthodes d’analyse chimique ou physique qui peuvent par exemple être:
La plupart des espèces chimiques peuvent être révélées grâce à une lampe UV, il est donc possible de faire appel à la chromatographie pour les identifier. Elle est réalisée en comparant un échantillon de l’espèce chimique produite avec un échantillon de l’espèce chimique pure. Voir fiche de cours “Chromatographie”
- La mesure de la température de fusion avec un banc Kofler
Si le produit de la synthèse est un solide alors il peut être identifié grâce à sa température de fusion. Celle-ci peut être déterminée à partir d’un échantillon sec du produit synthétisé en utilisant un banc Kofler. Voir fiche “température de fusion”
Rendement d’une synthèse
Qu’est-ce que le rendement d’une synthèse ?
Le rendement est une grandeur qui rend compte de l’efficacité d’une synthèse organique, il indique la proportion de produit réellement obtenue par rapport la quantité maximale qu’il serait théoriquement possible d’obtenir.
Notation et unité
Le rendement est le plus souvent noté avec la lettre grecque η (êta) mais il arrive que d’autres notations soient utilisées ( r, ρ..)
Le rendement n’a pas d’unité (étant donné qu’il est défini comme le rapport de deux grandeurs de même unité).
Calculer le rendement d’une synthèse
Le rendement correspond au rapport de la quantité d’espèce chimique synthétisée réellement obtenue (souvent notée nexp) par la quantité d’espèce chimique qui aurait dû être obtenue théoriquement dans des conditions idéales (souvent notée nmax ou nthéo)
On peut donc l’exprimer par la relation suivante:
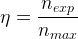

où:
- nexp est la quantité de matière de l’espèce chimique synthétisée déterminée à partir de la mesure expérimentale du volume ou de la masse du produit de synthèse après isolement et purification. Elle s’exprime en mole (mol)
- nmax est la quantité de matière maximale qu’il est théoriquement possible d’obtenir, elle est calculée à partir du tableau d’avancement de la réaction en supposant que la totalité du réactif limitant est consommé en respectant la stoechiométrie de l’équation de réaction. Elle s’exprime aussi en mole (mol)
Le rendement peut aussi parfois être exprimé sous la forme d’un pourcentage, dans ce cas il suffit de multiplier par “100” la valeur obtenue grâce à la formule précédente.
Sous forme de pourcentage le rendement s’exprime donc par la relation suivante:
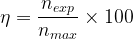

Valeur d’un rendement
Par définition la valeur d’un rendement est comprise entre 0 (0%) et 1 (100%)
Un rendement de “0” signifie que la synthèse n’a pas permis d’obtenir l’espèce chimique que l’on souhaitait produire.
Plusieurs hypothèses sont alors à examiner pour résoudre le problème:
- Les conditions pour que la transformation chimique se fasse ne sont peut-être pas réunies.
- L’un des réactifs a été oublié.
- L’un des Réactifs a été par erreur remplacé par une autre espèce chimique (le bécher contenant l’éthanol peut par exemple avoir été confondu avec celui contenant de l’eau distillée…)
- L’une des techniques d’extraction ou de purification n’est peut être pas adaptée et a éliminé l’espèce que l’on souhaitait isoler.
Un rendement de “1” signifie que la totalité du réactif limitant a été transformée en produit.
On pourrait se réjouir d’obtenir ce résultat mais en pratique le rendement n’est jamais maximal, les différentes opérations qui font partie d’un protocole de synthèse conduisent inévitablement à des pertes de matières plus ou moins importante et à des rendements toujours inférieurs à “1”.
Le rendement ne peut en aucun cas être supérieur à 1, un tel résultat est du soit à:
- une erreur de calcul
- une erreur de mesure
- un mauvais isolement du produit (il reste mélangé à du solvant, à d’autre produits ou à des réactifs non consommés)
Calculer un rendement à partir des masses de produit
La masse d’une espèce chimique donnée est proportionnelle à sa quantité de matière:
m = n x M
La masse est donc obtenue en multipliant la quantité de matière d’une espèce chimique par sa masse molaire “M”
Par conséquent le rapport de la masse du produit de synthèse mesurée (mexp) et la masse maximale que l’on pourrait obtenir calculée (mmax) est égal à:
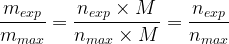

Le rendement peut donc aussi s’exprimer comme un rapport de masses:
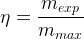

à condition que les deux masses soient exprimées avec la même unité (toutes les deux en gramme, ou toutes les deux en milligramme…)
Calculer un rendement à partir des volumes de produits
La masse d’une espèce chimique peut s’exprimer comme le produit de son volume “V” par sa masse volumique “ρ”:
m = ρ x V
Par ailleurs le rendement d’une synthèse peut s’exprimer par la relation suivante
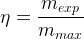

Cette expression devient:
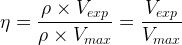

Dans le cas où l’ espèce chimique synthétisée est liquide alors le rendement de la réaction de synthèse peut être calculé grâce à la relation:
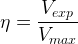

où:
- Vexp est le volume du produit obtenu grâce à la synthèse (mesuré)
- Vmax est le volume maximal qui devrait être obtenu (calculé)
Les deux volumes étant exprimés dans la même unité (tous les deux en litre ou tous les deux en millilitre…)
Comment expliquer que le rendement d’une synthèse soit faible ?
Voici une petite liste d’explications possibles à l’obtention d’un faible rendement:
- Les réactifs prélevés peuvent comporter des quantités de matière inférieures à celles prévues en raison de leur dégradation pendant leur stockage. (les espèces réductrices peuvent par exemple être oxydées par le dioxygène de l’air)
- Si l’eau distillée n’est pas pure elle peut contenir des gaz susceptibles de consommer une partie des réactifs ( le dioxyde de carbone peut réagir avec des espèces chimiques basiques, le dioxygène peut oxyder certaines espèces chimiques réductrices…)
- Il peut y a avoir perte de réactifs lorsque ceux-ci sont transvasés dans le milieu réactionnel (quelques gouttes peuvent rester dans les pipettes utilisées pour les prélever ou dans les béchers utilisés pour leur stockage temporaire)
- Il peut y avoir perte de réactifs ou de produit lors de l’étape de chauffage. Le chauffage à reflux limite ce risque mais ne le supprime pas entièrement (en particulier pour les espèces chimiques dont la température d’ébullition est proche de celle du solvant).
- Si l’étape de chauffage n’est pas assez longue alors la réaction de synthèse risque d’être interrompue avant que l’avancement de la réaction ne soit maximal et une partie des réactifs ne seront pas transformés.
- Certaines réactions sont naturellement “Limitées” et ne permettent pas de consommer la totalité des réactifs (ou du réactif limitant), elles aboutissent à un état d’équilibre entre réactifs et produits qui subsiste quelles que soient l’intensité et la durée du chauffage (c’est par exemple le cas des réactions de synthèse d’esther réalisées à partir d’un acide carboxylique et d’un alcool)
- Des réactions concurrentes “parasites” peuvent avoir lieu parallèlement à la réaction de synthèse. Elles consomment une partie des réactifs pour produire des espèces chimiques autres que celles prévues par le protocole de synthèse.
- Les étapes d’extraction et de purification sont susceptibles d’entraîner une perte de produit si elles ne sont pas réalisées correctement (utilisation d’un filtre défectueux, choix inadapté de solvant pour une extraction liquide-liquide, distillat recueillit trop tardivement lors d’une distillation…
A réviser
Cours de seconde:
- Corps purs et mélanges au quotidien
- Les espèces chimiques
- Les corps purs
- Mélanges d’espèces chimiques
- Mélanges homogènes et hétérogènes
- Test chimique d’identification
- La chromatographie
- Température d’ébullition d’une espèce chimique
- Température de fusion d’une espèce chimique
- La masse volumique
- Les solutions aqueuses, un exemple de mélange
- Les solutions aqueuses et leur préparation
- Transformation chimique
- Les réactifs d’une transformation chimique
- Les produits d’une transformation chimique
- Ecrire et équilibrer une équation de réaction
- Stoechiométrie
Les autres cours de première spécialité
- Quantité de matière, masse molaire et concentration
- Réaction d’oxydoréduction et avancement
- Titrage colorimétrique redox
- Schéma de Lewis, géométrie, électronégativité et polarisation
- Cohésion des solides, dissolution, solubilité, hydrophilie et lipophilie
- Structure et nomenclature des espèces organiques
Pour approfondir et découvrir
- Dossier “synthèse organique, la chimie au service de l’homme” – Site médiachimie
- Etapes d’une synthèse organique – Video du site scholawebTV su CRDP de Versailles
