pH d’une solution aqueuse et concentration en ion oxonium H3O+
à réviser avant d’aborder le cours sur les transformations acide-base:
Constitution et transformations de la matière – 1. Déterminer la composition d’un système par des méthodes physiques et chimiques – B) Analyser un système chimique par des méthodes physiques
- Déterminer le pH à partir de la concentration en ions oxonium
- Propriétés de la fonction logarithme décimal
- Calculer le pH d’une solution sans calculatrice
- pH d’une solution aqueuse d’acide fort
- Effet de la dilution sur le pH d’une solution
- Déterminer la concentration en ion oxonium à partir du pH
- La concentration en ion oxonium H3O+ dans une solution neutre
Déterminer le pH à partir de la concentration en ions oxonium
Le pH peut être exprimé à partir de la relation suivante
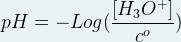
Dans cette relation:
- Le pH n’a pas d’unité
- “Log” correspond à la fonction mathématique “Logarithme décimal”
- [H3O+] est la concentration molaire exprimée en mole par litre (mol.L-1)
- c° est la concentration standard, c’est une constante qui vaut 1,00 mol.L-1 à condition que la concentration en ion oxonium soit bien exprimée en mole par litre.
Remarque
Etant donné que la concentration standard vaut 1,00 mol.L-1 cette relation peut être simplifiée, on obtient alors la formule suivante:
pH = – Log ([H3O+])
Comment utiliser cette formule pour trouver le pH d’une solution ?
- Déterminer la concentration en ion oxonium de la solution : elle peut être donnée dans l’énoncé d’un exercice, obtenue grâce à un calcul classique de concentration molaire à partir de la quantité de matière et du volume de la solution, elle peut être déduite de la concentration en acide dissout, elle peut être déduite de la concentration de la solution diluée.
- repérer la touche “Log” de votre calculatrice
- sur une calculatrice graphique (Casio, Texas instrument, NumWorks) il faut d’abord afficher la fonction Log à l’écran puis rentrer la valeur de la concentration en ion oxonium [H3O+] avant de valider.
- sur une calculatrice scientifique classique (non graphique) la valeur de la concentration doit en général d’abord être affichée à l’écran avant de valider.
- Inverser le signe de la valeur affichée par la calculatrice pour obtenir la valeur du pH (on pourrait aussi le noter à l’écran pour afficher directement la valeur du pH !)
Exemples de calculs de pH
- Une solution possède une concentration en ions oxonium [H3O+] = 0,0200 mol.L-1
pH = – Log (0,020)
pH = -1,70
- Solution de concentration en ions oxonium [H3O+] = 4,00.10-5 mol.L-1
pH = – Log (4,00.10-5)
pH = 4,40
Solution de concentration en ions oxonium [H3O+] = 1,00.10-6 mol.L-1
pH = – Log (1,00.10-6 )
pH = 6,00
Propriétés de la fonction logarithme décimal
Cette fonction a déjà été rencontrée en classe de première lors du cours d’enseignement scientifique “le son phénomène vibratoire” dans l’expression du niveau d’intensité sonore.
Attention à ne pas confondre la fonction logarithme décimal “Log” avec la fonction logarithme népérien “ln”
La fonction logarithme décimal est définie comme le rapport de la fonction logarithme népèrien par le logarithme népérien de 10:
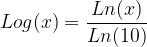
La fonction logarithme décimale partage donc certaines de ses propriétés avec la fonction logarithme népérien:
Elle est définie sur l’intervalle ] 0 ; +∞ [
Log ( a x b ) = Log ( a ) + Log (b)
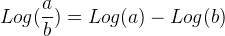
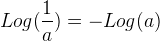
Lors d’un calcul de pH la propriété la plus utile est les suivantes:
Log (ak) = k x Log (a)
Log (10) = 1
La réciproque de la fonction logarithme décimal correspond à la fonction puissance de 10:
Si y = Log (x) alors x = 10y
Calculer le pH d’une solution sans calculatrice
Deux propriétés de la fonction logarithme décimale peuvent être particulièrement utiles pour calculer le pH:
Log (ak) = k x Log (a) et Log (10) = 1
Le calcul d’un pH s’en trouve nettement simplifié lorsque la concentration en ion oxonium s’exprime sous la forme d’une puissance de dix (10n)
Dans ce cas:
pH = – Log (10n)
pH = – n x Log (10)
pH = – n x 1
pH = -n
On en déduit donc que:
- Si [H3O+] = 10-1 mol.L-1 alors pH = – (-1) = 1
- Si [H3O+] = 10-2 mol.L-1 alors pH = – (-2) = 2
- Si [H3O+] = 10-3 mol.L-1 alors pH = – (-3) = 3
- Si [H3O+] = 10-4 mol.L-1 alors pH = 4
- Si [H3O+] = 10-5 mol.L-1 alors pH = 5
etc
pH d’une solution aqueuse d’acide fort
Un acide est dit “fort” si en solution aqueuse sa réaction est totale avec l’eau, la totalité de cet acide réagit donc avec l’eau qui forme son acide conjugué H3O+
Si AH est un acide fort du couple (AH/A–) alors il réagit avec l’eau suivant l’équation:
AH + H2O → A– + H3O+
C’est par exemple le cas du chlorure d’hydrogène (HCl), de l’acide nitrique (HNO3), de l’acide bromhydrique (HBr), de l’acide iodhydrique (HI), de l’acide perchlorique (HClO4) ou encore de l’acide chlorique (HClO3)
Dans ces conditions:
la quantité de matière en ion oxonium est égale à celle de l’acide dissout nH3O+= nAH
la concentration en ion oxonium est la même que celle de l’acide dissout: [H3O+]=[AH]
Exemple
Si l’on dissout du chlorure d’hydrogène dans de l’eau pure avec une concentration initiale [HCl]0 = 10-3 mol.L-1 alors:
- Tout le chlorure d’hydrogène dissout réagit avec l’eau suivant l’équation de réaction suivante:
HCl + H2O → Cl– + H3O+
- La concentration en ion oxonium est alors [H3O+]= [HCl]0 soit [H3O+]= 10-3 mol.L-1
Le pH de la solution est donc:
pH = – Log ([H3O+])
pH = – Log (10-3)
pH = 3
Remarque dans le cas d’un diacide (comme l’acide sulfurique H2SO4) chaque acide forme deux ions oxonium et [H3O+] = 2 x [H2SO4]
Effet de la dilution sur le pH d’une solution
La dilution d’une solution acide s’accompagne d’une diminution de la concentration en ions oxonium:
- [H3O+] diminue
- La fontion logarithme décimale est une fonction croissante, si [H3O+] diminue alors Log ([H3O+]) diminue aussi.
- Si Log ([H3O+]) diminune alors – Log ([H3O+]) augmente.
L’expression du pH en fonction de la concentration en ions oxonium permet de confirmer un résultat déjà connu:
La dilution d’une solution acide provoque donc une augmentation du pH
Pour rappel
Si une dilution est effectuée avec un facteur de dilution 10n sur une solution de concentration initiale en ion oxonium [H3O+]0 et de pH initial pH0 alors:
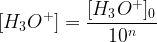
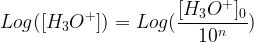
Log ([H3O+]) = Log ([H3O+]0) – Log (10n)
-Log ([H3O+]) = -Log ([H3O+]0) + Log (10n)
pH = pH0 + n x Log(10)
pH = pH0 + n x 1
pH = pH0 + n
Si une solution est diluée d’un facteur 10n alors son pH augment de “n” unité
Rappel
Une solution est diluée d’un facteur de dilution “F” si l’ajout de solvant multiplie son volume initial d’un facteur “F” ce qui conduit à diviser la concentration des solutés par “F”.
Exemple de dilution
On dilue une solution aqueuse de volume V0 =1,5mL, de concentration en ion oxonium C0 = 0,5 mol.L-1 , de pH pH0=0,3 en ajoutant de l’eau jusqu’à obtenir un volume de solution V1 = 150 mL.
Dans ce cas:
- le volume de la solution est multiplié par 100 ( puisque 1,5 x 100 = 150 mL)
- la concentration a été divisée par 100, elle passe de 0,5 mol.L-1 à 5.10-3 mol.L-1
- Le facteur de dilution est F = 100 soit F = 102
Puisque le facteur de dilution vaut 102 , il s’exprime sous la forme d’une puissance de “10” dont l’exposant est “2”, le pH augmente donc de deux unités, il passe de 0,3 à 2,3.
Si une solution acide est diluée d’un facteur 10 (101) alors le pH augmente de “1”
Si une solution acide est diluée d’un facteur 100 (102) alors le pH augmente de “2”
Si une solution acide est diluée d’un facteur 1000 (103) alors le pH augmente de “3”
Si une solution acide est diluée d’un facteur 104 alors le pH augmente de “4”
Si une solution acide est diluée d’un facteur 105 alors le pH augmente de “5”
etc
Attention, ce résultat (si une solution est diluée d’un facteur 10n alors son pH augmente de “n” unités) possède une limité de validité:
Une dilution ne permet pas de passer d’une solution acide à une solution basique par conséquent le pH maximal limite pour une dilution est 7
Au delà d’une certaine limite les ions oxonium issus de l’autoprotolyse de l’eau deviennent majoritaires par rapport à ceux issus d’un apport extérieur (provenant de la dissolution d’un soluté acide)
Déterminer la concentration en ions oxonium à partir du pH
- Pour déterminer la concentration en ion oxonium H3O+ à partir de la valeur du pH il suffit: d’exploiter l’expression du pH: pH = – Log ([H3O+])
- d’utiliser la fonction réciproque de la fonction logarithme décimal ( la fonction puissance de 10)
pH = – Log ([H3O+])
Log ([H3O+]) = -pH
10 Log ([H3O+]) = 10 (-pH)
[H3O+] = 10 (-pH)
[H3O+] = 10 (-pH)
Exemples
- Si pH = 2 alors la concentration en oxonium est [H3O+] = 10–2 mol.L-1
- Si pH = 3,8 alors la concentration en oxonium est [H3O+] = 10–3,8 mol.L-1 soit [H3O+] = 1,6.10-4 mol.L-1
La concentration en ions oxonium H3O+ dans une solution neutre
Une solution neutre est caractérisée par un pH de 7.
Si l’on applique la relation précédente pour déterminer la concentration en ions oxonium on obtient:
[H3O+] = 10-pH
[H3O+] = 10-7 mol.L-1
Une solution aqueuse neutre contient donc toujours des ions oxonium qui ne proviennent pas d’un apport extérieur (dissolution du soluté acide) mais qui se forment par une réaction entre molécules d’eau (réaction d’autoprotolyse de l’eau)
