Constitution et transformations de la matière – 1. Déterminer la composition d’un système par des méthodes physiques et chimiques – A) Modéliser des transformations acide-base par des transferts d’ion hydrogène H+
- Les acides et bases
- Comment reconnaitre une espèce chimique acide ?
- Comment reconnaitre une espèce chimique basique ?
- Acide et base conjuguée
- Couple acide-base
- Espèce chimique amphotère
- Demi-équation acide-base
- Couples acide-base de l’eau
- Les couples acide-base de l’acide carbonique
- Couple acide carboxylique / carboxylate
- Couple ammoniun / amine
- Les réactions acide-base
Partie du programme de physique-chimie de terminale spécialité sur les transformations acide-base:

Les acides et bases
- Définition d’un acide et d’une base selon Bronsted
Un acide est une espèce chimique susceptible de céder un ion hydrogène H+
Une base est une espèce chimique susceptible de capter un ion hydrogène H+
Cette définition a été proposée par le chimiste Danois Joannes Bronsted dans le cadre de sa théorie des acides et de bases.
D’après cette définition un acide est une espèce qui peut transférer un ion hydrogène à une autre espèce chimique lors d’une transformation chimique tandis qu’une base, au contraire, peut s’associer à un ion hydrogène pour former une nouvelle espèce chimique.
Notation AH d’un acide
Un acide peut être noté sous la forme Générale: AH
L’hydrogène figurant dans cette notation est celui qui est susceptible d’être cédé. Après transformation l’espèce formée possède donc:
- un hydrogène de moins
- une charge positive en moins
L’espèce acide AH forme donc l’epèce chimique de formule A–
Notation BH d’un acide
Un acide peut aussi être noté sous la forme générale: BH+
Dans cette formule, l’ion H+ pouvant être cédé, est mis en évidence.
Lorsqu’il est “perdu” par l’acide il reste l’espèce chimique B
Comment reconnaitre une espèce chimique acide ?
Par définition une espèce chimique acide doit posséder au moins un hydrogène qu’elle peut céder, par conséquent une espèce chimique acide doit comporter au moins un atome d’hydrogène ( une espèce sans hydrogène ne peut pas être acide).
Par ailleurs la présence d’hydrogène est une condition nécessaire mais non suffisante pour qu’une espèce chimique soir acide, il faut également qu’au moins l’un des atomes d’hydrogène puisse être cédé ce qui n’est possible que si la liaison avec cet hydrogène est polarisée.
L’hydrogène responsable de l’acidité dans une molécule doit donc être lié à un atome nettement plus électronégatif que lui.
Il en résulte qu’il est possible (mais ce n’est pas systématique!) qu’un hydrogène (électronégativité selon Pauling χ = 2,2) puisse être acide lorsqu’il est lié à:
- un atome d’oxygène (χ = 3,44)
- un atome d’azote (χ =3,04)
- un atome de chlore (χ =3,16)
- un atome de fluor (χ =3,98)
- un atome de brome (χ =2,96)
- un atome d’iode (χ =2,66)
- Un atome de soufre (χ = 2,58)
Par ailleurs il existe des fonctions chimiques incluant systématiquement un hydrogène “acide”. Lorsqu’une espèce chimique comporte une telle fonction elle est alors toujours acide. C’est par exemple le cas de la fonction “acide carboxilique”.
Si une espèce chimique se forme à partir d’une base qui capte un ion hydrogène alors elle susceptible de perdre à nouveau un ion hydrogène et donc d’être acide.
En résumé:
- Une espèce chimique est nécessairement acide si l’on peut observer qu’elle cède un ion hydrogène au cours d’une transformation chimique.
- Il est envisageable qu’une espèce chimique soit acide si au moins un hydrogène est lié à un atome plus électronégatif que lui.
- Il est exclu qu’une espèce chimique soit acide si elle ne comporte pas d’hydrogène ou si tous ses hydrogènes forment des liaisons non polarisées.
- Une espèce chimique est acide si elle porte une fonction chimique acide.
- Une espèce chimique peut être acide si elle provient d’une base qui capte un ion hydrogène.
Comment reconnaître une espèce chimique basique ?
Par définition une espèce chimique basique doit pouvoir capter un ion hydrogène H+. Ce dernier étant positif il ne peut être “capté” que par une zone à forte densité electonique: soit une charge négative, soit un doublet non liant.
Il est donc possible qu’une espèce chimique se comporte comme une base si elle comporte:
- un site anionique tel que -O– , -S2- , Cl–, I–, Br–, F–
- un atome portant un ou plusieurs doublets non liants comme l’azote
Par ailleurs certaines fonctions chimiques comportent systématiquement un site basique, c’est en particulier le cas des fonctions amines.
Si une espèce chimique se forme à partir d’un acide par perte d’un ion hydrogène alors elle possède un caractère basique car elle peut capter de nouveau l’ion hydrogène perdu.
En résumé:
- Une espèce chimique est basique si l’on peut observer qu’elle capte un ion hydrogène au cours d’une transformation chimique.
- Une espèce chimique est susceptible de posséder un caractère basique si elle possède un site anionique ou si elle comporte un atome doté de doublets non liants.
- Il est exclu qu’une espèce soit basique si elle est neutre et qu’aucun de ses atomes ne possède de doublet non liant (par exemple un alcane, un alcène ou un alcyne composé uniquement de carbone et d’hydrogène ne peut être basique)
- Une espèce chimique issue d’un acide ayant perdu un ion hydrogène est une base.
Acide et base conjuguée
Lorsqu’un acide perd un ion hydrogène il forme une espèce chimique basique car elle est susceptible de capter à nouveau un ion hydrogène.
Inversement lorsqu’une base capte un ion hydrogène elle forme une espèce chimique acide car elle peut de nouveau perdre cet ion hydrogène.
Lorsqu’un acide perd un ion hydrogène il forme sa base conjuguée
Lorsqu’une base capte un ion hydrogène elle forme son acide conjugué
Définition:
Un acide et une base sont conjugués entre eux si l’un s’obtient à partir de l’autre par échange d’un ion hydrogène.
Si un acide AH forme une base A– alors en cédant un ion hydrogène alors:
- A– est la base conjuguée de l’acide AH
- AH est l’acide conjugué de la base AH
Inversement, si une base A– capte un ion hydrogène pour former un acide AH alors:
- A– est la base conjuguée de l’acide AH
- AH est l’acide conjugué de la base AH
Exemples
- L’acide nitrique HNO3 peut céder un ion hydrogène et former un ion nitrate NO3– par conséquent NO3– est la base conjuguée de l’acide nitrique tandis que HNO3 est l’acide conjugué de NO3–.
- L’ammoniac NH3 peut capter un ion hydrogène pour former un ion ammonium NH4+ par conséquent NH4+ est l’acide conjugué de NH3 tandis que NH3 est la base conjuguée de NH4+ .
Couple acide-base
Définition
Un acide et sa base conjuguée forment un couple acide-base
Par conséquent lorsque deux espèces chimiques forment un couple acide-base alors l’un s’obtient à partir de l’autre par échange d’un ion hydrogène.
Exemples de couples acide-base:
- HCl et Cl–
- HCOOH et HCOO–
- NH4+ et NH3
Un couple acide-base est désigné par une notation de la forme (Acide/Base) où l’acide est toujours noté et en premier et la base en second.
Exemples:
- (HCl/Cl–)
- (HCOOH/HCOO–)
- (NH4+/NH3)
Espèce chimique amphotère
Définition
Une espèce chimique est dite amphotère si elle constitue la base d’un couple acide-base et l’acide d’un autre couple.
Une espèce chimique possède donc à la fois un caractère acide et un caractère basique:
Si une espèce chimique de la forme AH est amphotère alors elle la forme acide du couple acide-base (AH/A–), elle est la forme basique du couple acide-base (AH2+/AH)
Exemples d’espèces chimiques amphotères:
- L’eau H2O forme acide du couple (H2O/HO–) et forme basique du couple (H3O+/H2O)
- L’ion hydrogénocarbonate HCO3– forme acide du couple (HCO3–/CO32-) et forme basique du couple (H2CO3/HCO3–)
- L’ion hydrogénosulfate HSO4– forme acide du couple (HSO4–/SO42-) et forme basique du couple (H2SO4/HSO4–)
Demi-équation acide-base
A chaque couple acide-base on associe une demi-équation acide-base qui décrit l’échange d’ion hydrogène permettant de passer de la forme acide à la forme basique et inversement.
Une demi-équation acide-base est donc de la forme:
AH ⇆ A– + H+
ou
BH+ ⇆ B + H+
La double flêche (⇆) utilisée pour noter cette demi-équation indique que la transformation est susceptible de se faire dans les deux sens:
Soit l’acide se transforme en base AH→A– + H+ ouBH+→B + H+
Soit la base se transforme en acide A– + H+ → AHou B + H+ → BH+
Exemples
- Demi-équation du couple (HCl/Cl–): HCl ⇆Cl– + H+
- Demi-équation du couple (HCOOH/HCOO–): HCOOH ⇆ HCOO– + H+
- Demi-équation du couple (NH4+/NH3): NH4+ ⇆ NH3 + H+
Couples acide-base de l’eau
L’eau (H2O) appartient à deux couples acide-base ( H3O+/H2O) et ( H2O/OH–), c’est une espèce chimique amphotère
- Couple ( H3O+/H2O) – Couple ion oxonium/eau
Dans ce couple l’eau joue le rôle d’une base et son acide conjugué est l’ion oxonium (H3O+)
Demi-équation de réaction:
H3O+ ⇆ H2O + H+
- Couple (H2O/OH–) – Couple eau / ion hydroxyde
Dans ce couple l’eau joue le rôle d’un acide et sa base conjuguée est l’ion hydroxyde OH–
Demi-équation de réaction:
H2O ⇆ OH– + H+
L’eau est une espèce chimique amphotère, dans une solution aqueuse elle est susceptibe :
- en tant qu’acide du couple (H2O/OH–) de réagir avec les espèces chimiques basiques pour former sa base conjuguée OH–
- en tant que base du couple ( H3O+/H2O) de réagir avec les espèces chimiques acide pour former son acide conjugué H3O+
Les couples acide-base de l’acide carbonique
L’acide carbonique (formule brute H2CO3) se forme par réaction chimique entre le dioxyde de carbone (CO2) et l’eau:
CO2 + H2O → H2CO3
Formule semi-développée de l’acide carbonique:
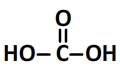
Schéma de Lewis de l’acide carbonique:
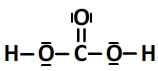
L’acide carbonique peut céder deux ions hydrogène H+, c’est un diacide
Il est l’acide du couple ( H2CO3 / HCO3–).
Sa base conjuguée est l’ion hydrogénocarbonate HCO3–qui peut elle même céder un ion hydrogène et jouer le rôle d’un acide sein du couple ( HCO3– / CO32-)
L’ion hydrogénocarbonate peut jouer le rôle d’un acide ou d’un base dans deux couples différents, par conséquent il s’agit d’une espèce chimique amphotère.
Equations de demi-réaction:
- Couple acide carbonique / ion hydrogénocarbonate ( H2CO3 / HCO3–) :
H2CO3 ⇆ HCO3–+ H+
HCO3–⇆CO32-+ H+
Couple acide carboxylique / carboxylate
Rappel: les acides carboxylique sont des espèces chimiques caractérisée par la présence d’un groupe carboxyle en bout de chaîne carbonée.
Leur formule est donc toujours de la forme R-COOH (R est un groupe carboné linéaire ou ramifié) et leur formule semi-développée:
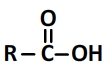
Leur schéma de Lewis est de la forme suivante
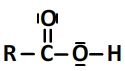
Un acide carboxylique peut céder l’hydrogène présent dans le groupe carboxyle.
La base formée est un ion carboxylate R-COO– dont la formule semi-développée est de la forme:
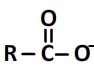
Et son schéma de Lewis est de la forme suivante:
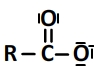
Un couple acide carboxylique / ion carboxylate (R-COOH/R-COO–) est caractérisé par une équation de réaction de la forme:
R-COOH ⇆ R-COO–+ H+
Exemple
L’acide éthanoïque (aussi appelé acide acétique) CH3COOH possède comme base conjuguée l’ion éthanoate CH3COO–
Leurs formules développées sont les suivantes:
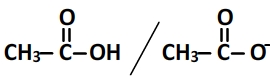
Leurs schémas de Lewis sont les suivants:
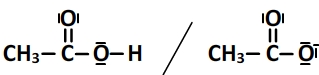
La demi-équation de réaction du couple est:
CH3COOH ⇆ CH3COO–+ H+
Couple ammoniun / amine
Rappel: les amine carboxylique sont des espèces chimiques caractérisée par la présence d’un groupe amino -NH2
Leur formule développée est donc toujours de la forme suivante (R est un groupe carboné linéaire ou ramifié) :
R-NH2
Leur schéma de Lewis est de la forme suivante
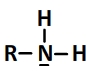
Une amine peut capter un ion hydrogène qui se fixe sur l’atome d’azote du groupe amino
L’acide formé est un ion ammonium dont la formule dévelopée est de la forme:
R-NH3+
Et son schéma de Lewis est de la forme suivante:
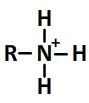
Un couple acide ammonium / amine est caractérisé par une équation de réaction de la forme:
R-NH3+⇆ R-NH2 + H+
Exemple
L’éthanamine possède comme acide conjugué l’ion éthanammonium
Les réactions acide-base
Une réaction acide-base peut avoir lieu entre l’acide d’un couple acide-base et la base d’un autre couple.
Il peut donc y avoir réaction entre l’acide A1H d’un couple (A1H/A1–) et la base A2– d’un couple (A2H/A2–)
Une réaction acide-base forme la base conjuguée du réactif acide et l’acide conjugué du réactif basique.
Une réaction acide-base est associée à une équation de réaction qui peut être obtenue par addition des demi-équations des deux couples qui interviennent.
Demi-équation du couple 1: A1H ⇆ A1– + H+
Demi-équation du couple 2: A2– + H+ ⇆ A2H
Addition: A1H + A2– + H+ ⇆ A1– + H+ + A2H
On peut simplifier en supprimant les ions hydrogène présents en même quantité à gauche et à droit de la double flêche et l’on obtient alors:
A1H + A2– ⇆ A1– + A2H
Dans le cas d’une réaction totale la double flèche est remplacée par une flèche simple:
A1H + A2– → A1– + A2H
Une équation de réaction acide base s’écrit donc toujours sous la forme:
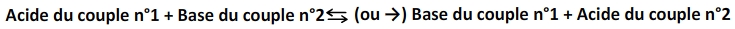
Exemple
Réaction entre l’acide éthanoïque CH3COOH et l’ammoniac NH3:
L’acide éthanoïque appartient au couple acide-base (CH3COOH/CH3COO–) , il forme donc sa bas conjuguée CH3COO–
L’ammoniac est la base du couple (NH4+/NH3) par conséquent elle forme son acide conjugué
Les réactifs sont CH3COOH et NH3 tandis que les produits sont CH3COO– et NH4+
L’équation de réaction acide-base peut s’obtenir par addition des demi-équations ou s’écrire directement:
CH3COOH + NH3 ⇆ CH3COO– + NH4+
