- Densité
- Titre massique
- Rappel sur le dosage par titrage
- Titrage avec un suivi pH-métrique
- Titrage avec un suivi conductimétrique

Voir cours de première spécialité Titrage colorimétrique redox
La densité
La densité est une grandeur sans unité notée « d » (comme le « d » de densité), elle est définie comme le rapport de la masse volumique d’une espèce chimique (ρespèce-chimique) par une la masse volumique de l’eau (ρeau) ce qui se traduit par la formule suivante :

En pratique la densité est surtout utilisée pour exprimer la masse volumique soit :
ρespèce-chimique = d x ρeau
Voir fiche de cours sur la densité:
Voir cours sur la masse volumique:
Et aussi sur la masse volumique de l’eau:
Le titre massique
Le titre massique est une grandeur qui reflète la proportion de masse de soluté dissout dans une solution, il peut s’exprimer sous deux formes différentes : Concentration en masse ou fraction massique
Tout d’abord il peut s’apparenter à la Concentration en masse.
Dans ce cas il se note en général « Cm » et correspond au rapport de la masse de soluté par le volume de solution :
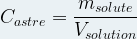
La masse est alors en gramme (g), le volume en litre (L) et le titre massique (Concentration en masse) est gramme par litre (g.L-1)
Le titre massique peut aussi s’apparenter à la fraction massique, dans ce cas il note « t » (parfois « w ») et correspond au rapport de la masse de soluté par la masse de solution :
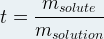
Les deux masses sont exprimées toutes les deux dans la même unité (en général en gramme) et le titre massique « t » n’a pas d’unité.
Remarque : dans ce dernier cas il peut être donné sous forme de pourcentage.
Rappel sur le dosage par titrage
Un titrage est une méthode permettant de déterminer la Concentration en masse ou en quantité de matière d’une espèce chimique dissoute en solution. C’est une méthode dite « destructive » car elle implique une transformation chimique entre cette espèce chimique (dite espèce titrée) et une autre espèce chimique appelée « espèce tritrante »
La réaction chimique mise en jeu lors d’un titrage est appelée réaction support, elle doit être rapide et totale.
Si la réaction support mise en jeu est une réaction acide-base alors le titrage est dit « acido-basique », si c’est une réaction d’oxydoréduction alors c’est un « titrage par oxydoréduction » est si la réaction support est une réaction de précipitation alors le titrage est dit « par précipitation »
Le titrage doit permettre de repérer le point d’équivalence, c’est à dire le point où les réactifs sont en proportions stoechiométriques, c’est le bilan de matière au point d’équivalence qui permet de trouver la concentration recherchée.
Titrage avec un suivi pH-métrique
Principe
Un titrage avec suivi pH-métrique exploite une réaction support acide-base entre un acide et une base :
- Si l’espèce chimique titrée est un acide alors l’espèce chimique titrante est une base.
- inversement, si l’espèce chimique titrée est une base alors l’espèce titrante doit être un acide.
Le pH est mesuré dans la solution titrée tout au long du dosage afin d’obtenir la courbe d’évolution du pH en fonction du volume de solution titrante ajoutée.
Grâce à cette courbe on peut déterminer le point équivalent dont l’abscisse correspond au volume équivalent Veq.
L’équivalence se caractérise par une variation rapide et importante du pH ce qui permet de localiser le point équivalent :
- soit à partir de la méthode des tangentes.
- soit par dérivation de la courbe de pH.
Le point équivalent est atteint à l’instant où les réactifs ont été introduits en proportions stoechiométriques par conséquent la connaissance du volume équivalent permet de déterminer la concentration inconnue.
Réalisation d’un titrage avec suivi pH-métrique
La solution à doser (solution titrée) est versée dans un bécher.
Le bécher doit comporter un barreau aimanté et être placé sur un agitateur magnétique de manière à maintenir une agitation pendant tout le dosage : cette agitation permet d’homogénéiser le mélange “solution titrée – solution titrante” et d’obtenir rapidement une concentration uniforme pour toutes les espèces chimiques.
Une sonde pH-métrique reliée à un pH-mètre doit plonger dans cette solution pendant le dosage afin de mesurer le pH après chaque ajout de solution titrante. Les valeurs de pH peuvent être relevées sur une feuille ou enregistrées numériquement en utilisant une interface.
L’enregistrement ne prend fin que lorsque le « saut de pH » (importante et rapide variation de pH) caractéristique de l’équivalence) a été nettement dépassé et que les mesures ainsi obtenues peuvent être exploitées lors d’une dérivation ou grâce à la méthode des tangentes.
Détermination du volume équivalent
Le volume équivalent peut être obtenu numériquement par dérivation par la courbe représentant l’évolution du pH en fonction du volume de solution titrante ajouté. Dans ce cas le volume équivalent correspond à au maximum de la dérivée.
Exemple : courbe de dosage acido-basique d’un comprimé d’ibuprofène par de l’hydroxyde de sodium de concentration Cb = 0,20 mol.L-1 (courbe extraite du sujet de bac physique chimie session de remplacement Antille-Guyane septembre 2013)
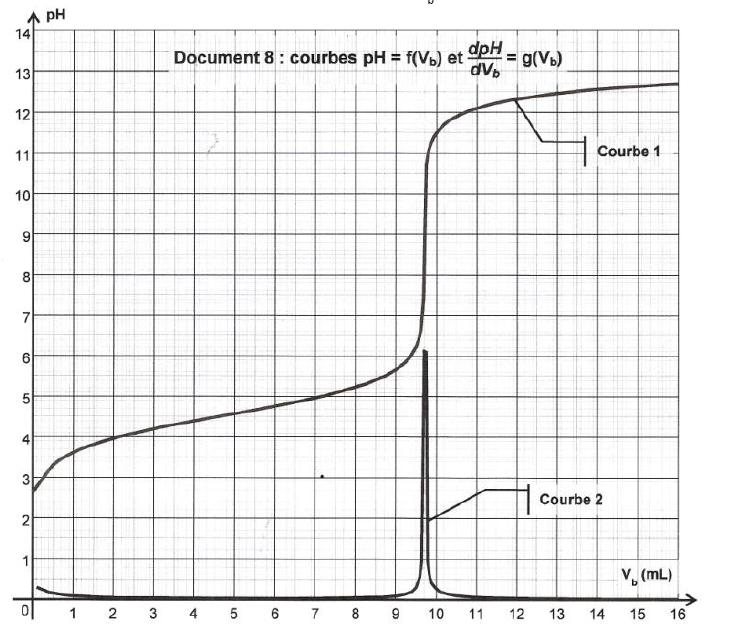
Sur ce graphe, la deuxième courbe est la courbe dérivée dont le maximum est atteint pour le volume Vb = 9,7 mL qui correspond au volume équivalent.
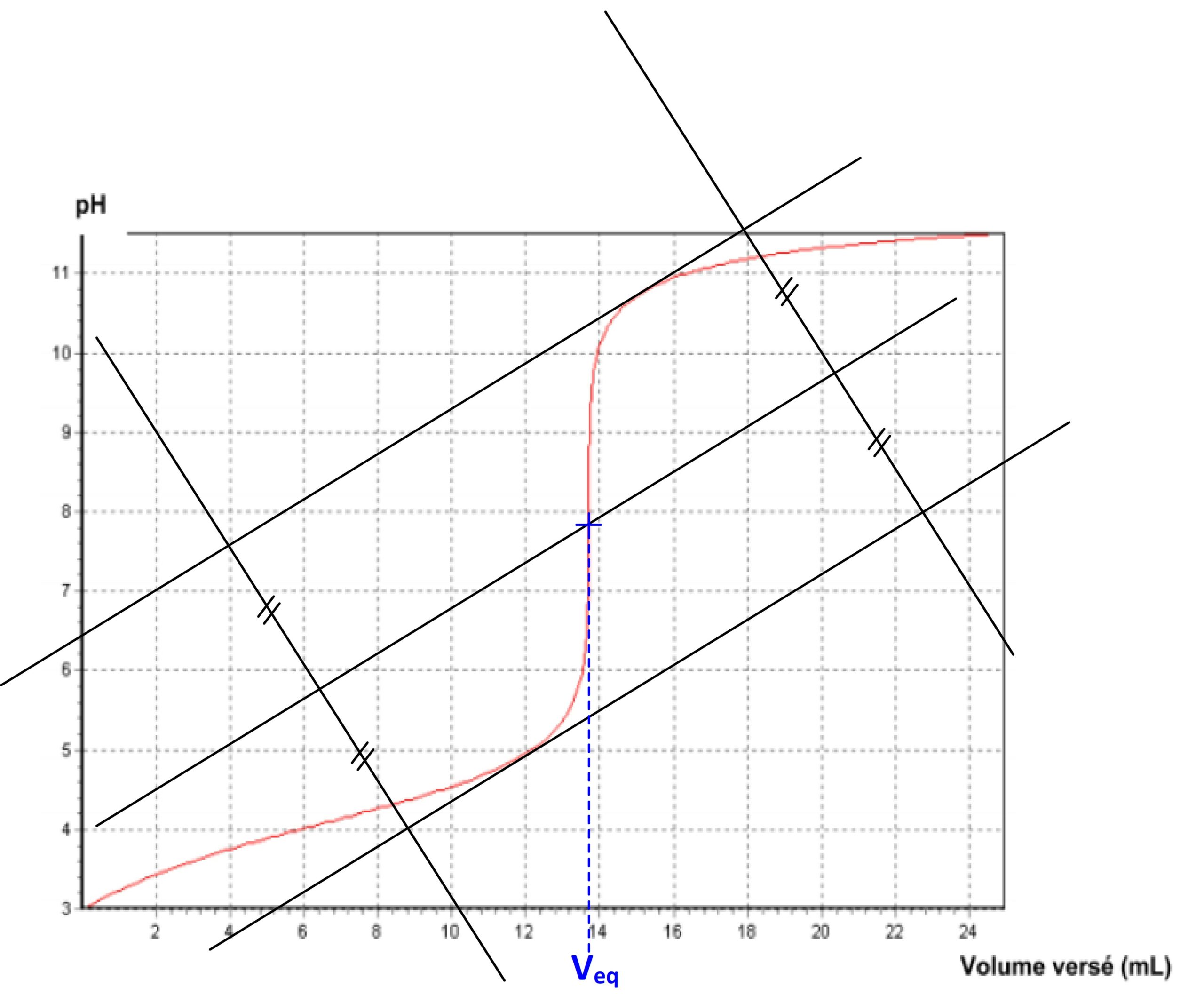
Le volume équivalent peut être obtenu par construction graphique grâce à la méthode des tangentes
Cette méthode consiste à tracer deux droites qui sont toutes les deux tangentes à la courbe de variation pH = f(Vsolution-titrante) :
- Le point de tangence de la première se trouve juste avant le saut de pH
- Le point de tangence de la deuxième se trouve juste après le saut de pH
- Ces deux tangentes sont parallèles entre elles
On utilise ces deux tangentes pour tracer une troisième droite :
- qui est parallèle au deux premières
- qui est située à égale distance de ces deux droites
Cette troisième droite coupe la courbe au niveau du point d’équivalence par conséquent son abscisse correspond au volume équivalent Veq
Déterminer la concentration de la solution titrée grâce au volume équivalent
Le dosage est réalisé dans les conditions suivantes :
- « A » est l’espèce chimique titrée et « B » est l’espèce chimique titrante
- Le volume initial de la solution titrée est VA0
- La concentration de la solution titrante est CB et celle de la solution titrée est CA
- Le volume équivalent a pour valeur Veq
- aA + bB → cC + dD est l’équation de réaction de la réaction support.
À l’équivalence les réactifs (espèce titrée A et espèce titrante B) sont mélangés en proportions stoechiométriques, cela correspond :
- à une quantité de matière nulle pour l’espèce chimique titrée A
- à une quantité de matière nulle pour l’espèce chimique titrante B
à l’équivalence :
nB = nB0 – b.x = 0 (1)
Dans l’égalité précédente “x” désigne l’avancement de la réaction, nB correspond à la quantité d’espèce titrante restant dans le mélange tandis que nB0 est la quantité d’espèce d’espèce titrante versée.
nA = nA0 – a.x= 0 (2)
Dans l’égalité précédente nA correspond à la quantité d’espèce titrée restant dans le mélange tandis que nA0 est la quantité d’espèce d’espèce titrée contenue initialement dans la solution titrée.
L’équation (1) permet d’obtenir la valeur de l’avancement maximal :
nB0 – b.x = 0
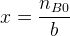
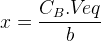
L’équation (2) permet de déterminer la quantité de matière initiale nA0 de l’espèce titrée puis d’en déduire sa concentration :
nA0 – a.x= 0
nA0 = a.x
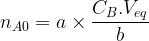
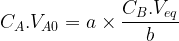
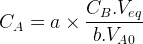
La relation qui permet de déterminer la concentration de la solution solution titrée est en général retenue sous la forme suivante :
b.CA.VA0 = a.CB.Veq
La plupart des titrages acido-basiques se font entre un monoacide et une monobase (un seul ion hydrogène échangé) par conséquent la réaction support de la forme suivante :
A + B → C + D
Les coefficients stoechiométriques de l’espèce titrante et de l’espèce titrée sont égaux à « 1 » et la relation permettant de déterminer la concentration de l’espèce titrée devient :
CA.VA0 = CB.Veq
Evolution des quantité de matière pendant un titrage pH-métrique
Avant le point d’équivalence
L’espèce titrée (A) est en excès par rapport à l’espèce chimique titrante (B), cette dernière est donc entièrement consommée .
Il reste en solution :
- L’espèce chimique titrée n’ayant pas encore été consommée
- Les produits de la réaction
- la quantité de matière de l’espèce chimique titrante est nulle
La quantité d’espèce titrante introduite et consommé est : nB0 = CB.VB
La quantité d’espèce titrante en solution est donc : nB = 0 mol
La quantité d’espèce titrée restante en solution est
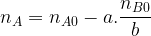
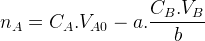
Si la réaction support de titrage se fait entre un monoacide et une monobase ( une seul ion hydrogène échangé, les coefficients stoechiométriques «a » et «b » sont tous les deux égaux à « 1 » alors cette quantité de matière devient :
nA = CA.VA0 – CB.VB
A l’équivalence
Par définition les réactifs on été introduits en proportions stoechiométrique, ils ont été entièrement consommée la solution ne contient plus d’espèce chimique titrante ni d’espèce chimique titrée :
nA = 0 et nB = 0
Après l’équivalence
L’espèce chimique titrée a entièrement réagi, il n’en reste plus en solution et l’espèce chimique titrante ne réagissant plus elle s’accumule.
La quantité d’espèce chimique titrée est nulle, nA = 0
La quantité d’espèce chimique titrante correspond à quantité ajoutée aprés l’équivalence c’est à dire :
nB = nB0-nBeq
nB = CB.VB – CB.Veq
nB = CB.(VB – Veq )
Titrage avec un suivi conductimétrique
Principe
Un titrage avec suivi conductimétrique exploite une réaction support qui fait intervenir des espèces chimiques ioniques.
La consommation et la formation d’ions s’accompagne d’une variation de conductivité qui évolue au fur et à mesure que la solution titrante est ajoutée dans la solution titrée.
La conductivité de la solution titrée est mesurée tout au long du dosage afin d’obtenir la courbe d’évolution de la conductivité en fonction du volume de solution titrante ajoutée.
Cette courbe permet de déterminer le point d’équivalence dont l’abscisse est le volume équivalent (Veq)
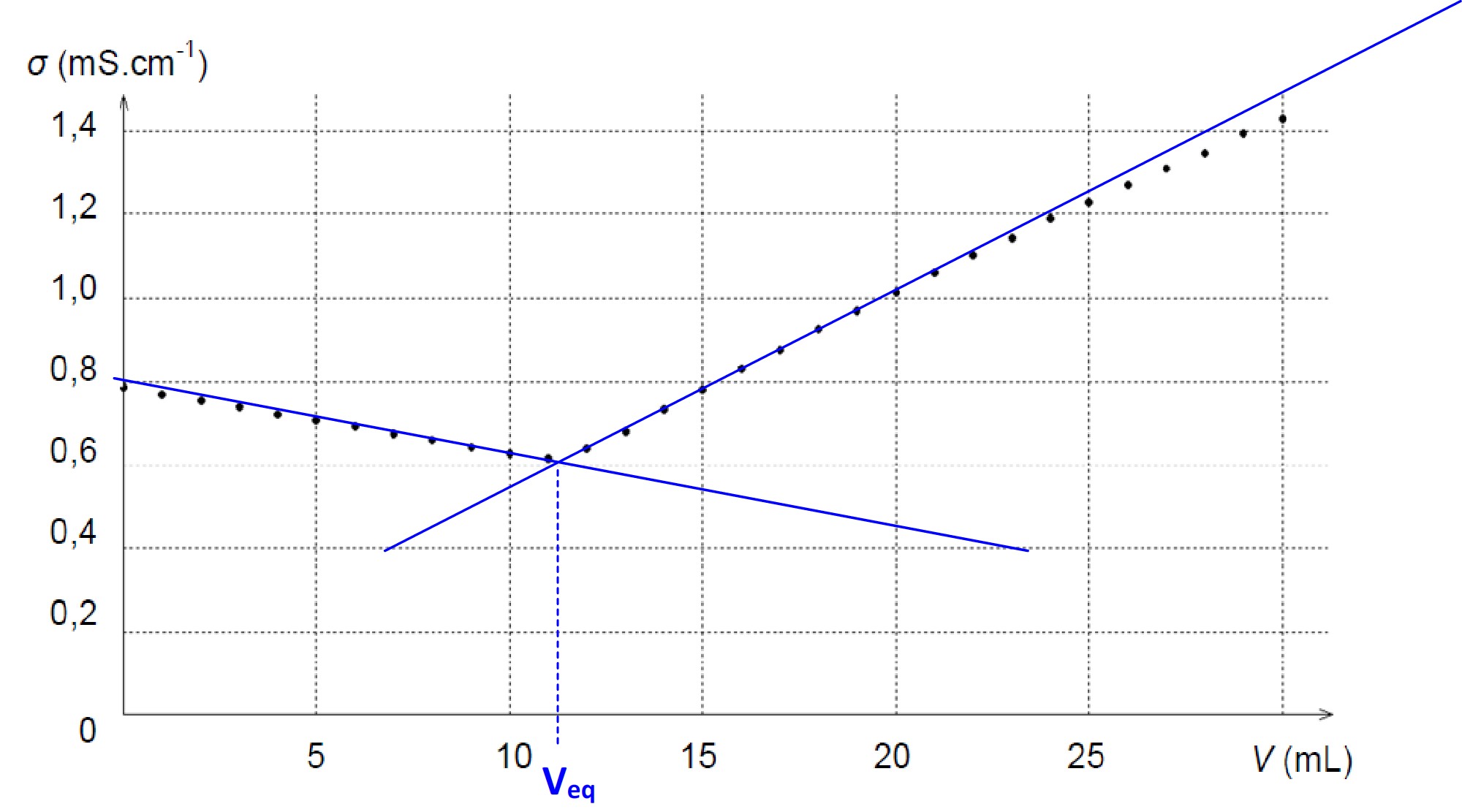
L’équivalence se se traduit par une variation de « pente », la conductivité évolue linéairement mais le coefficient directeur est différent avant et après l’équivalence : l’équivalence correspond au point où se manifeste une rupture de pente.
Lorsque le point équivalent est atteint les réactifs de la réaction support sont en proportions stoechiométriques ce qui permet d’établir une relation entre les quantités de matières des réactifs et d’en déduire la quantité initiale d’espèce titrée ainsi que sa concentration.
Réalisation d’un titrage avec suivi conductimétrique
La réalisation d’un titrage conductimétrique est comparable à celle d’un titrage pH-métrique (voir paragraphe sur la réalisation d’un titrage avec suivi pH-métrique)
Cependant le pH-mètre est remplacé par un conductimètre et la sonde pH-métrique est remplacée par une cellule de mesure conductimétrique.
Exemple : courbe de titrage d’une solution de chlorure de sodium par une solution de nitrate d’argent ( extrait sujet de bac physique-chimie 2018 enseignement de spécialité)
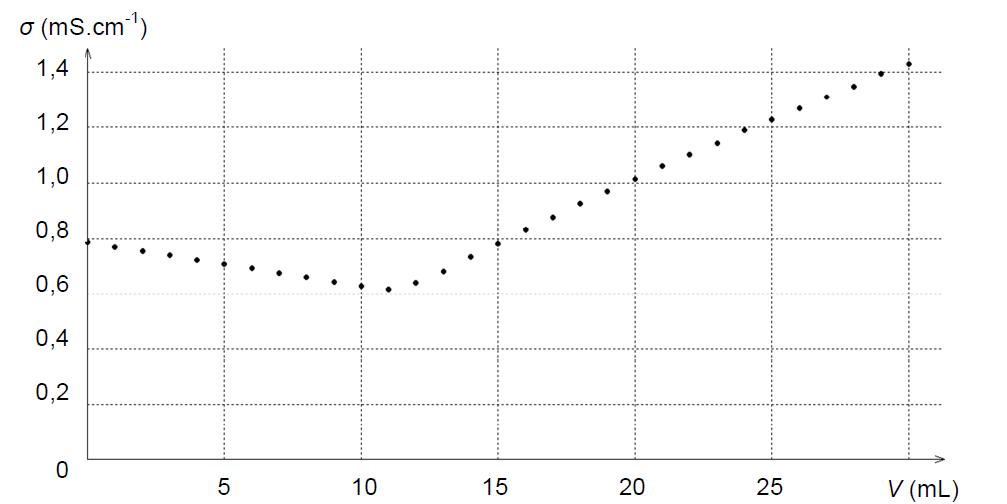
Détermination du volume équivalent
Le volume équivalent peut être obtenu en traçant les droites asymptotiques au deux parties linéaires de la courbe de dosage : le point d’intersection de ces deux droites correspond au point d’équivalence.