Composition chimique des dents
Une dent est composée de plusieurs couches différentes.
Celle où les caries se forment est la partie externe de la dent :
l’émail.
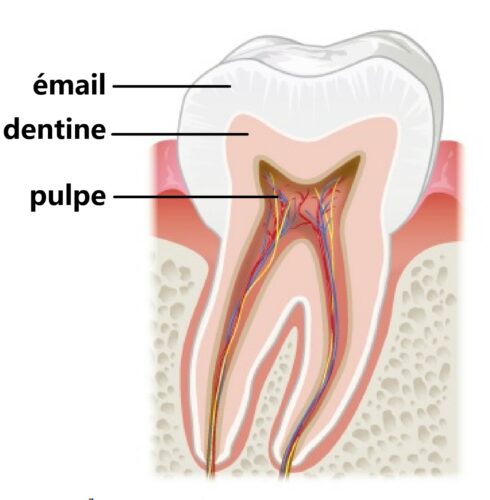
L’émail est principalement constitué d’un phosphate de calcium :
l’hydroxyapatite.
Sa formule chimique est :
Ca10(PO4)6(OH)2
C’est un composé ionique qui associe :
- des ions calcium Ca2+
- des ions phosphate PO43-
- des ions hydroxyde HO–
La plaque dentaire
La plaque dentaire est un film qui se forme naturellement à la surface de l’émail.
La plaque dentaire est constituée de bactéries et de résidus d’alimentaire.
Parmi les bactéries formant cette la plaque dentaire certaines sont impliquées dans le mécanisme de formation des caries :
- Certaines bactéries streptocoques ( en particulier streptococcus mutans mais aussi streptococcus sobrinus, sanguis, mitis, salivarius )
- Les lactobacilles
Ces bactéries métabolisent les glucides en formant de l’acide lactique
La formation des caries
Contrairement à une idée reçue une carie ne résulte pas d’une « attaque » directe de la dent par les bactéries: en réalité les bactéries se nourrissent des résidus d’aliments présents dans la bouche. Certaines transforment les glucides (les sucres) en acide.
Cet acide provoque une destruction localisé de l’émail qui est creusé : il s’agit de la carie.
La transformation des sucres en acide
Certaines bactéries réalisent une « fermentation lactique » des sucres en acide lactique.
Par exemple la fermentation lactique peut transformer le glucose (issu de l’hydrolyse du saccharose) en acide lactique suivant l’équation de réaction :
C6H12O6 → 2 C3H6O3
L’acide lactique
L’acide lactique a pour formule brute:
C3H6O3
Son nom, suivant la nomenclature UICPA, est acide 2-hydroxypropanoïque
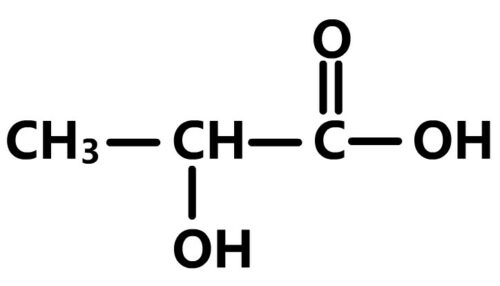
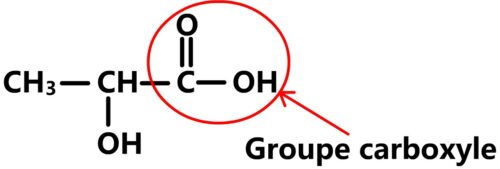
Sa formule semi-développée et son nom indiquent qu’il s’agit d’un acide carboxylique
L’acide lactique est un acide faible de pKa = 3,90
En solution aqueuse il réagit avec l’eau suivant l’équilibre suivant :
C3H6O3 + H2O = C3H5O3– + H3O+
L’acide lactique provoque donc une acidification, le pH diminue.
L’acide lactique est aussi présent dans le lait, il se forme à partir du lactose. Sa concentration y augmente progressivement (plus un lait est « frais » et moins il contient d’acide lactique).
L’acide lactique se forme aussi naturellement dans les muscles lors d’efforts trop intenses au cours desquels l’oxygène vient à manquer.
Réaction chimique de l’émail en milieu acide
Lorsque l’acidité, au sein de la plaque dentaire, atteint un seuil critique (le pH passe en dessous de 5,5) alors le phosphate de calcium qui constitue l’émail réagit avec les ions oxonium (H3O+) suivant l’équation suivante :
Ca10(PO4)6(OH)2 + 14 H3O+ → 10 Ca2+ + 6 H2PO4– + 16 H2O
Sous l’action des ions H3O+, l’émail se transforme en ions calcium Ca2+ et en ions dihydrogénophosphate H2PO4– solubles en solution aqueuse : ils sont éliminés de l’émail qui perd une partie de sa matière et se creuse (la carie se forme!)
Ce phénomène est aussi appelé « déminéralisation de la dent »
Reminéralisation
La bonne nouvelle est que la réaction chimique précédente n’est pas totale, il s’agit en réalité d’un équilibre que l’on devrait plutôt écrire avec une double flèche :
Ca10(PO4)6(OH)2 + 14 H3O+ ⇌ 10 Ca2+ + 6 H2PO4– + 16 H2O
Par conséquent si l’acidité diminue (le pH augmente) alors le phosphate de calcium peut se reformer et réintégrer l’émail : la dent se reminéralise.
Acidification de la salive
L’acide lactique produit par les bactéries de la plaque dentaire est susceptible de provoquer une baisse de pH localisée au sein de cette plaque par contre le pH de la salive reste stable car c’est une solution tampon.
Une salive normale a un pH compris environ entre 6 et 7,2 ( elle peut atteindre cette valeur légèrement basique lors des phases de sécrétion de salive)
Le pouvoir tampon de la salive est assurée principalement par les couples acide-base suivants:
- Le couple H2PO4– / HPO42- (dihydrogénophosphate / hydrogénophosphate) pKa=7,2
- Le couple H2CO3 / HCO3– (acide carbonique / hydrogénocarbonate) pKa=6,4
Comment éviter les caries ?
- On peut éliminer la plaque dentaire comportant les bactéries qui produisent de l’acide lactique grâce au brossage des dents.
- On peut éviter de « nourrir » les bactéries en limitant la consommation d’aliments sucrés en se brossant les dents
- On peut éviter de consommer régulièrement des produits acides qui peuvent agresser directement l’émail (comme les sodas)
