Constitution et transformations de la matière – 2. Modéliser l’évolution temporelle d’un système, siège d’une transformation – A) Suivre et modéliser l’évolution temporelle d’un système siège d’une transformation chimique
- La cinétique
- Les catalyseurs
- Les différents facteurs cinétiques
- Les vitesses volumiques
- Le temps de demi-réaction
- Loi de vitesse d’ordre 1
- Modélisation microscopique d’une transformation chimique
Partie du programme de physique-chimie de terminale spécialité consacrée à la cinétique chimique
La cinétique
Qu’est ce que la cinétique ?
Définition : la cinétique est une branche de la chimie consacrée à l’étude des vitesses des transformations chimiques.
Bien que certaines transformations chimiques puissent nous paraître très rapides (comme les réactions de précipitation, les réactions acide-base) aucune n’est réellement instantanée, tous les systèmes chimiques évoluent à une vitesse qui dépend de leur composition, de la nature des transformations chimiques ainsi que d’un certain nombre de facteurs physiques.
Inversement même si certains systèmes chimiques nous apparaissent « figés » ils peuvent évoluer lentement.
La cinétique permet :
- de mettre en évidence les facteurs qui peuvent influencer la vitesse d’évolution d’un système chimique
- de proposer des solutions pour accélérer certaines transformations chimiques (celles exploitée à échelle industrielle)
- de proposer des solutions pour ralentir certaines transformations chimique (les réactions de corrosion, d’oxydation)
- d’exprimer la vitesse d’une réaction chimique
- de mettre en relation la vitesse d’une transformation avec les mécanismes réactionnels qui interviennent.
Les catalyseurs
Qu’est-ce qu’un catalyseur ?
Définition : un catalyseur est une espèce chimique qui permet d’accélérer une transformation chimique, il augmente la vitesse de cette transformation sans modifier la nature ni la quantité des produits.
Un catalyseur n’est ni un réactif ni un produit, il est présent en même quantité avant et après l’évolution du système chimique.
Il intervient dans certains mécanismes réactionnels qui peuvent le consommer mais il est à nouveau produit (en même quantité) par d’autres.
Il permet de remplacer un acte élémentaire lent du mécanisme réactionnel par plusieurs autres actes élémentaires globalement plus rapides.
Au final un catalyseur introduit dans un système chimique siège d’une transformation chimique :
- permet au système chimique d’atteindre plus vite son état final
- ne modifie pas la quantité et la nature des réactifs consommés et des produits formés
- n’apparaît pas dans l’équation de réaction globale associée à la transformation chimique.
Remarques
- Seules certaines transformations peuvent être accélérées par des catalyseurs.
- Un catalyseur est propre à une transformation chimique donnée et dépend des mécanismes réactionnels mis en jeu. ( Un catalyseur est efficace pour une réaction ou une catégorie de réaction mais peut être sans effet sur d’autre réactions chimiques)
Les différents facteurs cinétiques
Différents facteurs peuvent avoir une influence sur la vitesse d’une transformation chimique (ils peuvent l’accélérer ou la ralentir), ces facteurs sont les suivants:
- La concentration des réactifs
- La température
- La pression
- Le solvant
- L’agitation
- L’état de division (bloc, poudre, fibre) dans lequel se présentent les réactifs
Cependant les deux principaux facteurs sont la température et la concentration des réactifs, une augmentation de ces derniers permets, dans la plupart des cas, d’accélérer les transformations chimiques.
Les vitesses volumiques
Pour chaque espèce chimique intervenant lors d’une transformation chimique on peut définir une vitesse volumique de disparition (pour les réactifs) ou une vitesse volumique d’apparition (pour les produits).
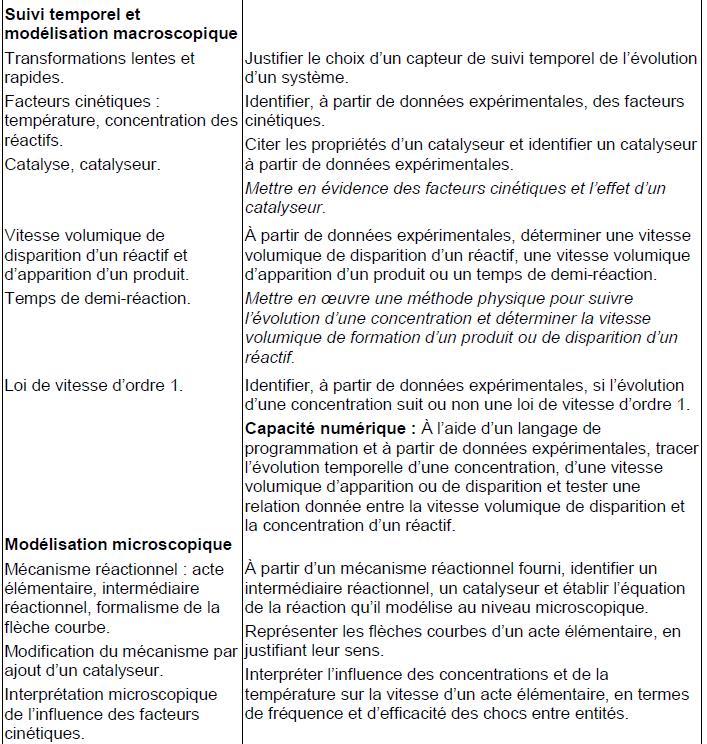
Pour une espèce chimique « X » la vitesse volumique (de disparition ou d’apparition) est définie comme la valeur absolue de la dérivée de la concentration molaire de cette espèce chimique par rapport au temps.
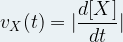
où
- vX(t), la vitesse volumique de l’espèce chimique (X) au temps « t » s’exprime en mole par litre et par seconde (mol.L-1.s-1)
- [X] est la concentration molaire de l’espèce chimique « X » au temps (t) en mole par litre (mol.L-1)
- t est le temps en seconde (s)
Il est possible de déterminer expérimentalement une vitesse volumique en suivant l’évolution de la concentration molaire d’un réactif ou d’un produit.
Si l’on détermine la concentration molaire [X](ti) au temps ti et la concentration molaire [X](ti+1) au temps ti+1 alors la vitesse volumique au temp ti s’exprime par la relation suivante :
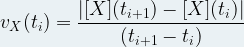
Il est possible de faire appel à différentes méthodes pour suivre l’évolution temporelle des concentrations:
- Si l’on souhaite déterminer la vitesse de disparition ou d’apparition de l’ion oxonium H3O+ alors on peut réaliser un suivi pH-métrique (puisque le pH est défini à partir de la concentration en ions oxonium)
- Dans le cas d’une espèce chimique ionique on peut réaliser un suivi pH-métrique
- Dans le cas d’une espèce chimique disposant d’une absorbance caractéristique il est possible de réaliser un suivi spectrophotométrique.
Remarque : il existe aussi une grandeur (distincte de la vitesse volumique) appelée « vitesse de réaction » définie à partir de la quantité de matière et non de la concentration.
La vitesse volumique évolue au cours d’une transformation chimique, elle tend à diminuer progressivement.
Le temps de demi-réaction
Pour une transformation chimique donnée le temps de demi-réaction, noté t1/2, est défini comme la durée d’évolution nécessaire pour que le système chimique puisse atteindre la moitié de l’avancement chimique final.
Si une transformation chimique est totale alors le temps demi-réaction correspond :
- au temps mis pour consommer la moitié de la quantité de matière initiale du réactif limitant
- au temps mis pour que se forme la moitié de la quantité finale de produit
Loi de vitesse d’ordre 1
Lorsqu’une réaction est dite d’ordre « 1 » par rapport à un réactif « X » donné alors la vitesse volumique vX est proportionnelle à la concentration [X ] de cette espèce chimique.
L’expression de la vitesse volumique est donc de la forme suivante :
vX(t) = k . [X]
où :
- vX(t) est la vitesse volumique de l’espèce chimique (X) au temps « t » en mole par litre et par seconde (mol.L-1.s-1)
- k est la constante de vitesse en seconde moins un (s-1)
- [X] est la concentration molaire en mole par litre (mol.L–1)
La constante de réaction dépend :
- de la transformation chimique
- du solvant
- des conditions physiques (température, pression)
La vitesse volumique d’une réaction d’ordre 1 est une fonction linéaire de la concentration molaire : sa représentation graphique vX(t) = f ([X]) est une droite passant par l’origine.
Modélisation microscopique d’une transformation chimique
Une transformation chimique comporte toujours plusieurs transformations chimiques intermédiaires appelées « actes ou étapes élémentaires ».
Le mécanisme réactionnel d’une transformation chimique correspond à l’ensemble des actes élémentaires qu’il comporte.
Un acte élémentaire consiste en une collision entre deux entités chimiques qui provoque la rupture de liaisons au sein de ces entités puis la formation de nouvelles liaisons.
Lorsque deux entités chimiques entrent en collision cela ne conduit pas nécessairement à un acte élémentaire, cela dépend de la vitesse des entités et de la manière dont elles sont orientées lors du choc.
Plus les collisions entre entités chimiques sont nombreuses et efficaces, plus cet acte élémentaire est rapide.
Chacun de ces actes élémentaires produits des espèces chimiques appelées « intermédiaires réactionnels » dont la présence dans le système chimique n’est que temporaire. Ils sont rapidement consommés à l’occasion d’un des actes élémentaires suivants et n’apparaissent pas dans le bilan global de la transformation chimique.
Pour décrire le mécanisme réactionnel d’une transformation chimique :
- On indique l’équation associée à chaque acte élémentaire
- On décrit la formation et la rupture de liaison en représentant le mouvement des doublets d’électrons à l’aide de flèches courbes
Par principe les doublets d’électrons susceptibles de « basculer » sont :
- les doublets non liants portés par un atome à électronégativité élevée portant une charge partielle négative (Oxygène, Chlore, Brome, Fluor, Azote…)
- Les doublets non liants portés par un site anionique
- Un des doublets liants participant à une liaison multiple (double ou triple)
Ces doublets peuvent basculer vers:
- Un atome présentant une important charge partielle positive
- Un site cationique
