Enseignement scientifique de première – Partie 1 – Une longue histoire de la matière – 1.1 – Un niveau d’organisation : les éléments chimiques
- La nucléosynthèse
- La nucléosynthèse primordiale
- La nucléosynthèse stellaire
- Nous sommes de la poussière d’étoile
- La fusion nucléaire
- La fission nucléaire
- Abondance des éléments chimiques
- La radioactivité
- La demi-vie
La nucléosynthèse
Ce mot (nucléosynthèse) est formé par association de deux autres mots:
- “nucléo” qui provient de “nucleus” signifiant “noyau”
- “synthèse” qui désigne une production
Définition
La nucléosynthèse est un processus permettant la production des noyaux atomiques
On distingue deux principales catégories de nucléosynthèse:
- la nucléosynthèse primordiale
- la nucléosynthèse stellaire
La nucléosynthèse primordiale
Selon la théorie du Big Bang, la naissance de l’Univers s’accompagne d’une gigantesque libération d’énergie dans un espace de faibles dimensions.
Cette énergie conduit à la formation des premiers nucléons (les protons et les neutrons).
Remarque
La formule E = m x c2 (qui sera vue plus en détail dans le chapitre sur le rayonnement solaire ) montre que toute masse “m” correspond à une énergie “E” et qu’inversement une énergie “E” peut prendre une forme matérielle de masse “m”.
Très vite ces nucléons s’associent pour former des noyaux (légers quelques nucléons) .
La plupart sont des noyaux d’hydrogène ou d’hélium.
La nucléosynthèse primordiale a lieu peu après la naissance de l’Univers et conduit principalement à la formation de noyaux d’hydrogène et d’hélium.
La nucléosynthèse stellaire
Définition
La nucléosynthèse stellaire correspond à la production de noyaux atomiques par les étoiles.
Lors du cycle de vie d’une étoile on distingue deux phases de nucléosynthèse stellaire:
La phase calme et la phase explosive
La phase calme de nucléosynthèse
Il s’agit de la phase la plus longue qui débute à la naissance de l’étoile et se poursuit tant que l’étoile est stable jusqu’à la fin de son existence. Les réactions de fusion nucléaire qui se produisent dans le coeur de l’étoile permettent de transformer des noyaux légers (principalement l’hydorgène et l’hélium) en d’autres noyaux légers (principalement de l’hélium, du bore, du lithium, du carbone et de l’oxygène)
Les étoiles tirent leur énergie des réactions de fusion nucléaire.
La phase explosive de la nucléosynthèse stellaire
L’épuisemenent de l’hydrogène et le début de la synthèse de noyaux atomiques de fer marque la fin de la stabilité d’une étoile et le début de la phase explosive au cours de laquelle l’étoile finit par exploser (forme une supernova):
- Les réactions de fusion nucléaire se poursuivent et produisent des noyaux beaucoup plus “lourd”.
- L’enveloppe de l’étoile et tous les élements synthétisés sont dispersés dans l’espace.
La nucléosynthèse stellaire permet de produire tous les éléments chimiques à partir de noyaux d’hydrogène et d’hélium.
Nous sommes de la poussière d’étoile
C’est l’astrophysicien Carl Sagan qui a été le premier à utiliser l’expression “poussière d’étoile” comme titre de l’un de ses livres, elle a ensuite été reprise par l’astrophysicien Canadien francophone Hubert Reeves.

“nous sommes de la poussière d’étoile” est une expression imagée qui traduit le fait que la plupart des éléments nous constituant ont été produits au sein d’anciennes étoiles avant d’être dispersés dans l’espace à la fin de leur existence puis de participer à la formation de systèmes planétaires autour de nouvelles étoiles:
- Une étoile produit de nouveaux éléments chimiques par fusion nucléaire au cours de la phase calme dans un premier temps puis au cours de la phase explosive à la fin de son existence.
- A la fin de son existence une étoile explose (supernova) et disperse sa matière ( l’hydrogène, l’hélium non consommés ainsi les éléments produits tels que le carbone, l’azote, l’oxygène) dans l’espace.
- Ces éléments se dispersent parmi les nébuleuses environnantes qui peuvent, si les conditions sont réunies, former de nouvelles étoiles entourées de planètes concentrant les éléments chimiques produits par les étoiles précédentes.
- Le carbone, l’azote, l’oxygène, le soufre que qui constituent les espèces organiques (et donc les êtres vivants ) proviennent tous d’anciennes étoiles
L’existence des espèces chimiques constituant les êtres vivant et la Terre n’est possible que grâce aux éléments chimiques produits par les précédentes générations d’étoiles.
La fusion nucléaire
Définition
La fusion est une transformation nucléaire qui permet de transformer deux noyaux atomiques légers en un noyau plus lourd.
Remarques:
- Le terme “noyaux légers” désigne des noyaux comportant peu de nucléons. Lors de la phase calme de la nucléosynthèse stellaire ces noyaux sont le plus souvent des noyaux d’hyrdogène ou d’hélium
- Un “noyau lourd” est un noyau comportant davantage de nucléons que chacun des noyaux réactifs de la fusion.
- Lors d’une fusion nucléaire peuvent intervenir d’autres particules ou antiparticules (neutrons, protons, électrons, antiélectrons, neutrinos) et des rayonnements peuvent être émis.
Comment vérifier qu’une transformation nucléaire est une fusion ?
Pour vérifier qu’une tranformation est une fusion nucléaire il faut déterminer le nombre de nucléons dans chacun des réactifs et des produits: si l’un des noyaux produits comporte davantage de nucléons que chacun des noyaux réactifs alors la transformation est bien une fusion nucléaire.
La fusion nécessite des températures élevées, largement atteintes dans les étoiles par contre elle n’est pas encore exploitée dans les centrales nucéaires.
Le bilan des transformations se produisant au sein d’une étoile pendant sa phase calme correspond à la fusion de 4 noyaux d’hydrogène 1 formant 2 noyaux d’hélium 4 ainsi qu’un positon et un neutrino.
Ce bilan peut se résumer par l’équation de réaction nucléaire suivante:
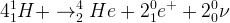
Pour le détail des étapes intermédiaires voir cours “Le rayonnement solaire“ , partie “Les réactions de fusion nucléaire dans le Soleil”
La fission nucléaire
La fission est un autre type de transformation nucléaire différente de la fusion
Définition
Une fusion nucléaire est une transformation au cours de laquelle un noyau est “divisé” en noyaux plus légers.
Caractéristiques d’une fission
- Les noyaux qui peuvent subir une fission sont des noyaux “lourds”, c’est à dire des noyaux comportant un grand nombre de nucléons (en général plus d’une centaine). Ces noyaux sont moins stables à cause du grand nombre de nucléons qu’ils comportent.
- La fission d’un noyau lourd est provoquée par le choc entre ce noyau lourd et une autre particule (le plus souvent un neutron)
- Lors de la fission sont également émises des particules telles que des neutrons, des neutrinos mais aussi des rayonnements (souvent des rayonnements gamma).
Lorsqu’une fission s’accompagne de l’émission de neutrons alors il peut y avoir réaction en chaîne: les neutrons émis permettent de provoquer la fission d’autres noyaux qui s’accompagne aussi de l’émission de neutrons et ainsi de suite…
Exemple de réaction de fission nucléaire
Lorsqu’un noyau de plutonium 239 rentre en collision avec un neutron alors il peut se fragmenter en un noyau de molybdène 102 et en un noyau de Tellure 135 tout en libérant 3 neutrons.
Cette réaction de fission nucléaire peut se traduire par l’équation de réaction nucléaire suivante:
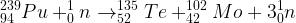
Abondance des éléments chimiques
- A l’échelle de l’Univers
A l’échelle de l’Univers les deux éléments les plus abondants sont l’hydrogène (H) et l’hélium (He)
Ce sont les deux principaux éléments formés lors de la nucléosynthèse primordiale.
Abondance des éléments en pourcentage massique dans l’Univers
| Élément chimique | Pourcentage massique |
| Hydrogène (H) | 73,9 |
| Hélium (He) | 24 |
| Oxygène (O) | 1 |
| Carbone (C) | 0,5 |
| Néon (Ne) | 0,1 |
| Fer (Fe) | 0,1 |
| Azote (N) | 0,1 |
| Silicium (Si) | 0,07 |
| Magnésium (Mg) | 0,06 |
| Soufre (S) | 0,04 |
Les proportions varient légèrement si l’on ne considère plus le pourcentage en masse mais le pourcentage en nombre d’atomes.
Abondance des éléments en pourcentage d’atomes dans l’Univers
| Élément chimique | Pourcentage d’atome |
| Hydrogène (H) | 90 |
| Hélium (He) | 9 |
| Oxygène (O) | 0,10 |
| Carbone (C) | 0,06 |
| Néon (Ne) | 0,012 |
| Fer (Fe) | 0,004 |
| Azote (N) | 0,01 |
| Silicium (Si) | 0,005 |
| Magnésium (Mg) | 0,005 |
| Soufre (S) | 0,002 |
- A l’échelle d’une étoile comme le Soleil
A l’échelle du Soleil et des autres étoiles l’hydrogène et l’hélium sont les deux éléments nettement majoritaires
Il est logique de retrouver dans une étoile les éléments également majoritaires à l’échelle de l’Univers puisque ce dernier (plus précisément ses nébuleuses) est à l’origine de la matière donnant naissance aux étoiles.
Abondance des éléments en pourcentage d’atomes dans le Soleil
| Élément chimique | Pourcentage d’atome |
| Hydrogène (H) | 91,2 |
| Hélium (He) | 8,7 |
| Oxygène (O) | 0.078 |
| Carbone (C) | 0.043 |
| Néon (Ne) | 0.0035 |
| Fer (Fe) | 0.0030 |
| Azote (N) | 0.0088 |
| Silicium (Si) | 0.0045 |
| Magnésium (Mg) | 0.0038 |
| Soufre (S) | 0.0015 |
- A l’échelle de la croûte terrestre
A l’échelle de la croute terrestre les deux éléments nettement majoritaires sont l’oxygène (O) et le silicium (Si). Le Fer, l’aluminium et le calcium sont également présents en proportions importantes.
Abondance des éléments en pourcentage d’atomes dans la croute terrestre
| Élément chimique | Pourcentage d’atome |
| Hydrogène (H) | 0,14 |
| Oxygène (O) | 46,1 |
| Carbone (C) | 0,19 |
| Fer (Fe) | 5,63 |
| Silicium (Si) | 28,2 |
| Magnésium (Mg) | 2,33 |
| Aluminium (Al) | 8,23 |
| Calcium (Ca) | 4,15 |
| Sodium (Na) | 2,36 |
| Potassium (K) | 2,09 |
| Titane (Ti) | 0,565 |
A l’échelle d’une planète tellurique comme la Terre, les éléments chimiques majoritaires diffèrent de ceux de l’Univers et des étoiles car elle concentre des éléments chimiques plus lourds.
- A l’échelle d’un être vivant
Les êtres vivants (hommes, animaux, plantes…) sont essentiellement constitués d’oxygène, d’hydrogène, de carbone et d’azote.
La prédominance de l’oxygène et de l’hydrogène résulte de la présence d’eau (constituée d’oxygène et d’hydrogène) dans tous les tissus vivants (le corps humain comporte près de 70% d’eau).
Les tissus vivants sont aussi constitués d’espèces organiques qui sont à l’origine du carbone et de l’azote présents chez les êtres vivants mais elles renferment aussi une partie de l’hydrogène et de l’oxygène.
Abondance des éléments en pourcentage d’atomes dans le corps humain
| Élément chimique | Pourcentage d’atome |
| Hydrogène (H) | 61 |
| Oxygène (O) | 24,1 |
| Carbone (C) | 12,6 |
| Azote (N) | 1,4 |
| Phosphore (P) | 0,25 |
| Calcium (Ca) | 0,24 |
| Potassium (K) | 0,06 |
| Soufre | 0,05 |
| Sodium (Na) | 0,03 |
| Chlore (Cl) | 0,03 |
La radioactivité
Définition
La “radioactivité” correspond à la transformation nucléaire au cours de laquelle un noyau radioactif instable se transforme spontanément en un autre noyau.
Lors d’une transformation radioactive:
- Un noyau radioactif réactif se transforme en un autre noyau comportant un nombre différent de protons et avec un nombre de nucléons proches (ce nombre peut être identique ou inférieur de 4 unités)
- Il y a émission d’une petite particule qui peut être un électron, un positon, un noyau d’hélium (particule alpha) et éventuellement des neutrinos.
- Il y a émission de rayonnements (rayons X ou rayonnements gamma)
- Les régles de conservations relatives aux transformations nucléaires (conservation du nombre total de nucléons et de la charge totale) sont respectées;
Le vocabulaire de la radioactivité
- La désintrégration: La transformation nucléaire que subit un noyau radioactif est appelée “désintégration” (on précise parfois “désintégration radioactive”). Attention, contrairement à ce que pourrait laisser supposer ce terme, le noyau qui subit une désintégration ne cesse pas d’exister mais forme d’autres entités (noyaux et particules)
- Radionucléïde: un noyau instable susceptible de subir une désintégration radioactive est appelé radionucléïde. Par exemple le carbone 14 est un isotope radioactif du carbone, on peut dire qu’il s’agit d’un radionucléïde.
- Noyau père et Noyau fils: lorsqu’un noyau subit une désintégartion il est qualifié de noyau pére et le noyau qui se forme à l’issue de cette désintégration est appelé noyau fils. Par exemple l’uranium 238 peut se désintégrer en formant un noyau de Thorium 234, l’uranium 238 joue alors le rôle de noyau père tandis que le thorium 234 joue le rôle de noyau fils.
- Demie-vie: voir paragraphe suivant
Propriétés de la radioactivité
Les désintégrations radioactives sont spontanées, aléatoires et inéluctables
- Elles sont spontanées, cela signifie qu’elles surviennent sans qu’aucun facteur exterieur au noyau radioactif n’ait d’influence sur leur déclenchement. (on ne peut pas provoquer une désintégration, elle se produit seule)
- Elles sont aléatoires, c’est à dire qu’au sein d’une population de noyaux radioactifs il n’est pas possible de prévoir individuellement, pour chaque noyau, l’instant de sa désintégration. La désintégration des noyaux radioactifs est régie par des loies “statistiques” (on peut prévoir la proportion de noyaux qui vont se désintégrer au bout d’une certaine durée mais il est impossible de préciser lesquels vont se désintégrer).
- Elles sont inéluctables, en d’autres termes rien ne peut les empêcher de se produire.
Exemple de désintégration radioactive
Un noyau d’uranium 238 peut se désintègrer en formant un noyau de thorium 234 et un noyau d’hélium 4 (particule α), cette désintégration peut être traduite par l’équation suivante :
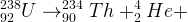
La demi-vie
La demi-vie est une grandeur qui permet d’indiquer le rythme auquel se font les désintégrations d’un échantillon de radionucléïdes.
Définition
La demi-vie d’un radionucléïde correspond à la durée nécessaire pour que la moitié des noyaux d’un échantillon de ce radionucléïde subissent une désintégration.
Au bout d’une demi-vie la population initiale de noyaux d’un radionucléïde est divisée par deux.
Notation et unité
La demi-vie se note t1/2 ou parfois T1/2 (“t” ou “T” comme temps)
Puisque la demi-vie est une durée elle s’exprime à l’aide d’une unité de temps comme la seconde, la minute, l’année etc. (en général l’unité de temps utilisée est celle la mieux adaptée à son ordre de grandeur).
Evolution au cours du temps d’une population de radionucléïdes
Si une population de noyaux est composée à un instant initial t = 0 d’un nombre N0 de radionucléïdes identiques caractérisés par une demi-vie t1/2 alors:
- Au bout d’une durée t = t1/2 il reste
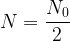 noyaux
noyaux - S’il s’écoule une demi-vie supplémentaire, c’est à dire au bout d’une durée totale t = 2 x t1/2 alors la population de noyaux restants au bout de la première demi-vie (
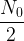 ) est elle-même divisée par deux et il reste donc
) est elle-même divisée par deux et il reste donc 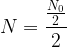 soit
soit 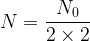 ou encore
ou encore 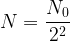
- S’il s’écoule une troisième demi-vie, c’est à dire au bout d’une durée totale t = 3 x t1/2 alors la population de noyaux restants au bout de la deuxième demi-vie (
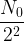 ) est elle-même divisée par deux et il reste donc
) est elle-même divisée par deux et il reste donc 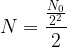 soit
soit 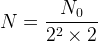 ou encore
ou encore 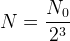
en répétant le raisonnement on obtient donc que:
- à t = 4 x t1/2
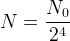
- à t = 5 x t1/2
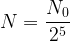
- à t = 6 x t1/2
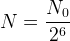
etc
D’une manière générale, au bout d’un nombre “n” de demi-vie la population initiale de noyaux est divisée par 2n
Soit:
à t =n x t1/2 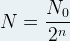
L’évolution d’une population de radionucléïdes peut donc toujours être décrite par une courbe ayant la forme suivante:
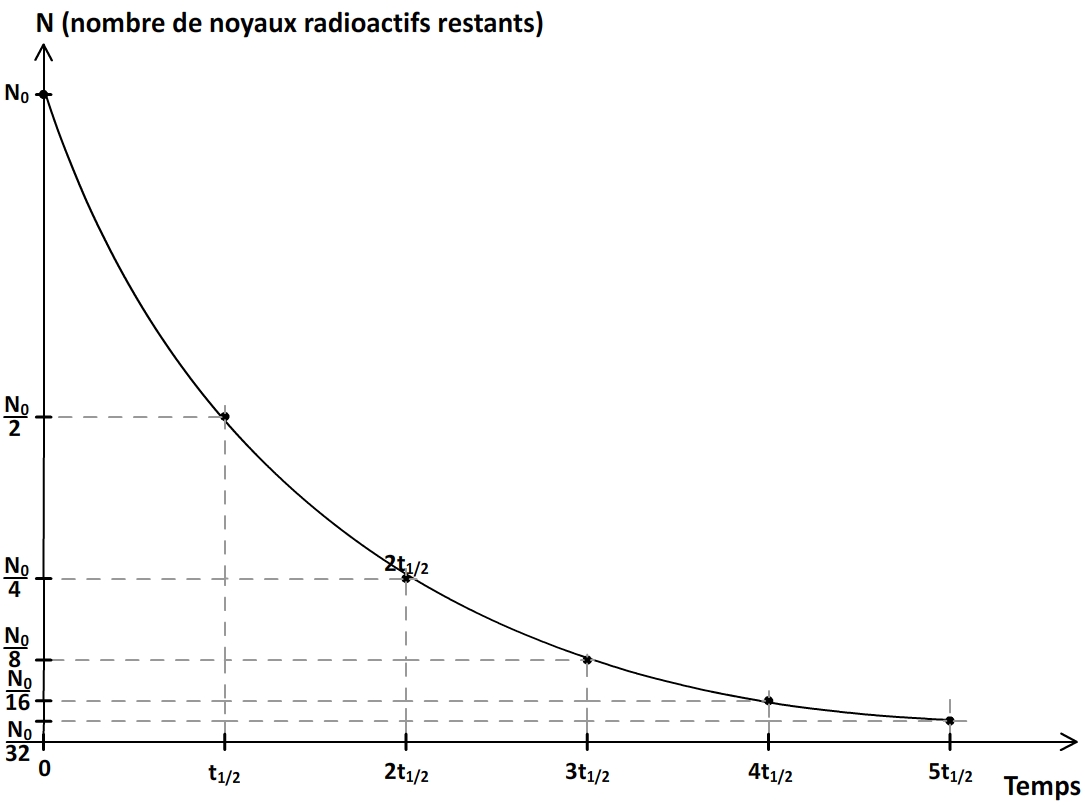
Quelques demi-vies
Chaque radionucléïde possède sa propre demi-vie, celle-ci peut avoir une valeur de quelques millièmes de seconde à plusieur centaines de milliard d’années.
Voici quelques exemples
| Radionucléïde | Demi-vie t1/2 |
| Béryllium 8 | 6,7.10-17 s |
| Polonium 215 | 1,83 ms |
| Radon 220 | 54,20 s |
| Molybdène 99 | 65,94 h |
| Iode 131 | 8,02 J |
| Thorium 234 | 24,1 J |
| Polonium 210 | 138,37 J |
| Cobalt 60 | 5,27 ans |
| Krypton 85 | 10,76 ans |
| Radium 226 | 1602 ans |
| Carbone 14 | 5730 ans |
| Plutonium 239 | 24110 ans |
| Uranium 234 | 245 500 ans |
| Uranium 235 | 703,8 millions d’années |
| Uranium 238 | 4,5 milliard d’années |
| Vanadium 50 | 1,5 x 1017 ans |
| Bismuth 209 | 1,9 x 109 ans |
Evaluer la durée nécessaire pour obtenir un nombre de radionculéïdes donné
On souhaite déterminer le temps au bout duquel une population composée de initialement d’un nombre N0 de radionucléïde de demi-vie t1/2 atteint une population de N1 noyaux.
II faut dans un premier temps exprimer la population N1 comme le rapport du nombre initial de noyaux N0 divisé par “2” élevé à une puissance “n” ou “n” correspondant au nombre de demi-vie ecoulées pour évoluer jusqu’à une population N1.
On peut écrire:
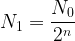
où “n” est le nombre inconnu de demi-vies que l’on cherche à déterminer.
Cette relation peut s’écrire:
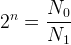
Pour résoudre cette équation et trouver “n” on peut utiliser les propriétés de la fonction logarithme :
log (ab) = b x log (a)
Si l’on prend le logarithme de chacun des membres de l’égalité précédente on obtient:
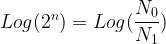
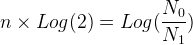
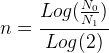
La durée nécessaire pour passer d’une population de N0 noyaux à une population de N1 noyaux est donc:
t = n x t1/2
t = 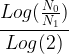 x t1/2
x t1/2
Application: on souhaite déterminer la durée nécessaire pour qu’une population de radionucléïdes soit divisée par 100.
On a donc par conséquent:
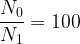
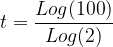 x t1/2
x t1/2
t = 6,64 x t1/2
Une population de radionucléïde est donc divisée par 100 au bout de 6,64 demi-vies.
