- Calculer une densité
- Unité et notation
- Utiliser une densité pour calculer une masse volumique
- Prévoir si un solide flotte ou coule
- Prévoir la position d’une phase liquide par rapport à une autre
- Les facteurs dont dépend la densité
- Densité d’un gaz
- Mouvements de convection dans un fluide
- Tableau de densités
Calculer une densité
Définition: pour un liquide ou un solide la densité est définie comme le rapport de la masse volumique du solide ou du liquide par celle de l’eau pure prise à la température de référence de 3,98 °C. Cette eau pure a une masse volumique qui vaut exactement 1,000 kg/L (1000 kg/m3).
Formule: 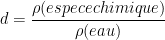
Cette relation est vérifiée uniquement si les deux masses volumiques sont exprimées dans la même unité. Si l’on choisit une unité pour laquelle la masse volumique de l’eau est 1 (en kg/L, g/L, kg/dm3, ou g/cm3) alors la densité possède la même valeur que la masse volumique.
Unité et notation
La densité se note la première lettre de son nom: d (toujours en minuscule)
Etant définie comme le rapport de deux grandeurs qui ont la même unité, elle ne possède aucune “dimension”, elle ne peut être exprimée naturellement en fonction d’aucune unité de base (mètre, kilogramme, joule, coulomb etc..). Il aurait été possible de lui rattachée une nouvelle unité spécifiquement définie mais il a été décidée de la laisser sans unité.
Utiliser une densité pour calculer une masse volumique
Il est fréquent que les données expérimentales indiquent la densité au lieu de la masse volumique (surtout pour les liquides) mais on peut facilement obtenir une relation qui permette de calculer cette dernière.
Selon la relation qui définit la densité:
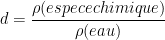
d . ρ(eau) = ρ(espèce chimique)
On obtient donc la relation suivante qui permet de calculer la masse volumique:
ρ(espèce chimique) = d . ρ(eau)
Cette relation est surtout utile dans le cas où l’on souhaite utiliser une unité pour laquelle la masse volumique est différente de un.
Prévoir si un solide flotte ou coule
La poussée d’Archimède s’exerce verticalement, vers le haut sur tout corps plongé dans un liquide, cette poussée a pour valeur le poids du liquide déplacée par le corps immergée. Si un corps possède un poids supérieur à celui du volume de liquide qu’il déplace alors la résultante des forces est orientées vers la bas et il coule sinon il flotte.
On peut ainsi montrer, pour un solide compact dont le volume de matière correspond au volume de liquide déplacé que:
- Si la densité du solide est supérieure à celle du liquide, il coule
- Si la densité du solide est inférieure à celle du liquide, il flotte.
- Si le liquide en question est de l’eau, il garde une densité proche de 1 sur un large intervalle de température (de 0,999841 pour 0°C à 0,98803 pour 50°C) et l’on peut considérer qu’un solide ne flotte que s’il a une densité inférieur à 1.
Prévoir la position d’une phase liquide par rapport à une autre
La densité peut également être utilisée pour repérer différentes phases liquides d’un mélange hétérogène, ce qui peut être particulièrement pratique par exemple lorsqu’on réalise une extraction par solvant dans une ampoule à décanter.
Le poussée d’Archimède s’applique également sur les fluides (liquides et gaz) et conduit au résultat suivant: le liquide qui possède la plus faible densité constitue la phase supérieure et celui qui a la densité la plus élevée constitue la phase inférieure.
Les facteurs dont dépend la densité
La densité d’une substance dépend des mêmes facteurs que sa masse volumique:
- sa composition chimique
- de la pression
- de la température.
Une augmentation de température s’accompagne le plus souvent d’une baisse de la densité tandis qu’une augmentation de pression provoque une hausse de la densité. Lorsqu’aucune mention de pression ou de température n’est faite, on sous-entend en général que la densité est exprimée dans des conditions normales (à une température de 0°C et sous une pression d’une atmosphère)
Densité d’un gaz
Pour un gaz, la densité est définie comme le rapport de la masse volumique de ce gaz par la masse volumique d’un gaz de référence:
dgaz= ρgaz
ρgaz de référence
En général le gaz de référence est l’air pris dans les même conditions de pression et de température que le gaz. Dans ce cas, et si les conditions permettent de les assimiler à des gaz parfaits, alors leur masse volumique peut être exprimée grâce à la loi des gaz parfaits (voir fiche masse volumique):
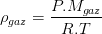
et
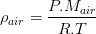
donc
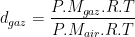
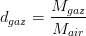
La densité d’un gaz correspond donc au rapport de la masse molaire de gaz par la masse molaire de l’air qui vaut (lorsqu’il est sec) Mair = 28,96 g/mol. Par conséquent la densité d’un gaz est proportionnel à sa masse molaire, il en découle donc que:
- Plus la masse molaire d’un gaz est élevée et plus il est dense
- A l’air libre un gaz de masse molaire supérieure à 28,96 g/mol aura tendance à s’enfoncer dans l’air et à stagner au niveau du sol.
- A l’air libre un gaz de masse molaire inférieur à 28,96 g/mol aura tendance à s’élever.
Dans certains cas, en particulier lorsqu’on a besoin de comparer des couches d’air de températures différentes, on choisit comme gaz de référence l’air à une température de 0°C (273,15°K) sous une pression d’une atmosphère (P = 101325 Pa).
Mouvements de convection dans un fluide
Dans un fluide (liquide ou gaz) des variations de densité conduisent certaines couches à s’élever et d’autres à s’élever sous l’effet des forces de pressions (qui sont résumées par la poussée d’Archimède):
- Dans les couches les moins denses le fluide s’élève
- Dans les couches les plus denses, le fluide descend
Ces mouvements ascendants et descendants constituent des mouvements dits de convection qui se produisent notamment dans l’atmosphère et les milieux marins.
Dans l’air ce sont les différence de températures qui induisent des différence de densité:
- l’air chaud, moins dense, s’élève.
- l’air froid, plus dense, descend.
Dans les mers et océans les variations de densité peuvent être causée par deux facteurs qui sont la température (comme dans l’air) et la salinité (la concentration en sels).
- Une eau chaude est en général moins dense qu’une eau froide (même si le phénomène est d’une amplitude nettement moindre que celle des gaz) et tends à remonter tandis qu’une eau froide à tendance à être plus dense et à couler.
- Une eau plus salée est plus dense et tend à descendre.
Remarque
Les variations de la densité de l’eau en fonction de la température ne sont pas continues, l’eau présente un minimun de densité à 4°C et autour cette valeur il est possible qu’une eau plus froide soit moins dense (par exemple, l’eau pure à 1°C est moins dense que l’eau pure à 4°C).
Tableau de densités
|
Matériau |
Densité |
|
METAUX |
|
|
Argent |
10,5 |
|
Bismuth |
9,80 |
|
Cobalt |
8,80 |
|
Cuivre |
8,94 à 8,96 |
|
Etain |
7,20 à 7,30 |
|
Fer |
7,86 à 7,87 |
|
Iridium |
22,4 |
|
Magnésium |
1,74 à 1,76 |
|
Mercure |
13,6 |
|
Nickel |
8,0 à 8,9 |
|
Or |
19,3 à 19,5 |
|
Platine |
21,4 à 21,5 |
|
Plomb |
11,4 |
|
Titane |
4,51 |
|
Tungstène |
19,3 |
|
Zinc |
7,1 |
|
ALLIAGES |
|
|
Acier inoxydable |
8,01 |
|
Bronze |
8,4 à 9,2 |
|
Fonte |
7,3 à 7,4 |
|
Laiton |
7,3 à 8,4 |
|
MINERAUX |
|
|
Agathe |
2,5 à 2,7 |
|
Argile |
1,7 à 2,59 |
|
Béryl |
2,69 à 2,71 |
|
Béton |
1,9 à 2,8 |
|
Brique |
1,4 à 2,2 |
|
Craie |
1,9 à 2,80 |
|
Diamant |
3,01 à 3,52 |
|
Glace |
0,926 |
|
Granit |
2,64 à 2,75 |
|
Grenat |
3,16 à 4,29 |
|
Marbre |
2,7 à 2,8 |
|
Opale |
2,19 |
|
Porcelaine |
2,29 à 4,50 |
|
Quartz |
2,6 à 2,7 |
|
Sable |
1,6 à 1,7 |
|
Silex |
2,63 |
|
Topaze |
3,51 à 3,57 |
|
Verre |
2,40 à 2,80 |
|
SUBSTANCES ORGANIQUES |
|
|
Bambou |
0,304 à 0,400 |
|
Beurre |
0,845 à 0,865 |
|
Bois d’acajou |
0,65 à 0,70 |
|
Bois de chène |
0,60 à 0,98 |
|
Bois de peuplier |
0,39 |
|
Bois de platane |
0,65 |
|
Bois de saule |
0,384 à 0,593 |
|
Caoutchouc |
0,98 |
|
Cire d’abeille |
0,960 à 0,978 |
|
Ivoire |
1,83-1,92 |
|
Liège |
0,22 à 0,26 |
|
Os |
1,70 à 2,00 |
|
Papier |
0,705 à 1,15 |
|
Paraffine |
0,864 à 0,913 |
|
Sucre |
1,59 |
|
MATIERES PLASTIQUES |
|
|
Polypropylène |
0,85 à 0,92 |
|
Polypropylène basse densité |
0,89 à 0,93 |
|
Polypropylène haute densité |
0,94 à 0,98 |
|
Polystyrène |
1,04 à 1,06 |
|
Nylon |
1,12 à 1,16 |
|
PVC |
1,19 à 1,35 |
|
Polyéthylène |
1,38 à 1,41 |
|
Bakélite |
1,35 à 1,40 |
|
Acétone |
0,79 |
|
Acide acétique |
1, 05 |
|
Eau |
1,0 |
|
Eau de mer |
1,03 |
|
Essence |
0,75 |
|
Ethanol |
0,789 |
|
Ether |
0,710 |
|
Gasoil |
0,850 |
|
Glycérine |
1,260 |
|
Huile d’olives |
0,920 |
|
Lait |
|

merci bien, j’ai révisé mes cours.