Cours de chimie niveau seconde –2. Modélisation des transformations de la matière et transfert d’énergie– B) Transformations physiques
- Propriétés macroscopiques de l’état liquide
- Propriétés microscopiques de l’état liquide
- Transformations physiques de l’état liquide
- Effets d’un échange d’énergie thermique sur un liquide
- Comment savoir si un corps est à l’état liquide ?
- Quelques corps à l’état liquide dans les conditions usuelles
Propriétés macroscopiques de l’état liquide
Remarque
On peut faire l’approximation que “macroscopique” est synonyme d’ “échelle humaine”
Un liquide ne possède pas de forme propre
Il occupe le fond du contenant qui le reçoit et en épouse la forme: Si un liquide est versé dans un bécher alors il occupe le fond de ce bécher et adopte une forme cylindrique mais s’il est transvasé dans un ballon alors il prend une forme sphérique.
Un liquide possède un volume propre
Le volume d’un liquide garde la même valeur quel que soit le récipient où il est versé: un volume de liquide reste le même dans un bécher, une éprouvette, un erlenmeyer où n’importe quel autre récipient.
Remarques
- Cette propriété est vraie si la température ne change pas car la masse volumique d’un liquide dépend de la température (et aussi, dans une moindre mesure, de la pression).
- En pratique, pour que cette propriété se vérifie, il faut qu’il n’y ait pas de perte de liquide lorsque celui-ci est transvasé.
Un liquide est un fluide (comme les gaz) et possède (tout comme les gaz) la propriété de pouvoir s’écouler.
Un liquide au repos (sans mouvement) possède toujours une surface libre (surface supérieure en contact avec l’air) plane et horizontale. Ce n’est pas le cas pour les solides (l’éventuelle surface libre n’est pas nécéssairement plane ni horizontale) ni pour les gaz (qui ne disposent en général pas de surface libre).

former une bulle – Photo prise par l’astronaute Leroy Chiao dans la station
spatiale internationale
En résumé, un liquide:
- possède un volume propre
- n’a pas de forme propre
- peut s’écouler
- a une surface libre plane et horizontale lorsqu’il est au repos
Propriétés microscopiques de l’état liquide
Les entités chimiques constituant un liquide peuvent être:
- des atomes (par exemple dans le mercure ou tout autre métal fondu)
- des molécules (par exemple des molécules d’eau, d’éthanol)
- des ions (par exemple des sels fondus comme le chlorure de calcium ou l’hydroxyde de sodium)
Les entités chimiques qui constituent un liquide restent au contact les unes des autres (comme dans un solide) et occupent par conséquent un espace réduit: pour cette raison l’état liquide est dit compact.
Les entités chimiques d’un liquide sont également libres de se déplacer au sein de ce liquide avec la restriction de rester en contact les unes avec les autres: elles sont toujours en mouvement et ne possèdent pas de position attribuée de manière définitive ce qui fait de l’état liquide un état désordonné.
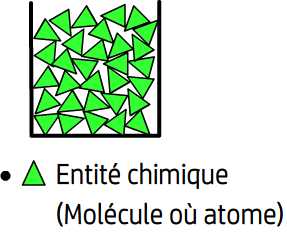

Au niveau microscopique l’état liquide est un état compact et désordonné
Transformations physiques de l’état liquide
Les deux principales transformations physiques que peut subir un liquide sont la solidification et la vaporisation.
La solidification est le passage de l’état liquide à l’état solide, elle survient lorsque le liquide atteint sa température de solidification (qui est égale à sa température de fusion) et cède de l’énergie thermique au milieu extérieur.
La vaporisation est le passage de l’état liquide à l’état gazeux, elle peut se produire de deux manières différentes: l’évaporation ou l’ébullition.
- L’évaporation: c’est un phénomène de surface progressif qui se produit à toutes températures (dans la limite des températures de solidification et d’ébullition). Une partie de entités chimiques présentes en surface du liquide passent à l’état gazeux.
- L’ébullition: elle se produit lorsque le liquide est à sa température d’ébullition, l’ensemble du liquide tend alors à passer à l’état gazeux. et il s’y forme des “poches de gaz” (des bulles).
Effets d’un échange d’énergie thermique sur un liquide
Si un liquide n’est ni à sa température de solidification ni à sa température d’ébullition alors:
- de l’énergie thermique reçue provoque une hausse de température ainsi qu’un accroissement de l’agitation des entités chimiques.
- de l’énergie thermique cédée au milieu extérieur provoque une baisse de température et une diminution de l’agitation des entités chimiques.
Si un liquide est à sa température de solidification alors l’énergie thermique cédée au milieu extérieur provoque une solidification (partielle ou totale selon la quantité d’énergie cédée). Au niveau microscopique l’agitation thermique n’est plus assez forte pour vaincre les forces attractives qui s’exercent entre les entités chimiques: celles-ci perdent la possibilité de déplacer.
Si un liquide est à sa température d’ébullition alors de l’énergie thermique reçue provoque une ébullition(complète ou partielle selon la quantité) . Au niveau microscopique l’agitation thermique devient si importante que les forces attractives qui s’exercent entre les entités chimiques ne peuvent plus les maintenir en contact: elles se peuvent alors se déplacer librement sans aucune contrainte.
Comment savoir si un corps est à l’état liquide ?
Pour savoir est un corps est à liquide on peut:
- utiliser les propriétés macroscopiques du liquide
Il suffit de et vérifier soit que ce corps possède un volume propre mais de forme propre où que sa surface libre reste plane et horizontale au repos.
- utiliser les propriétés microscopiques.
Il faut alors vérifier que les entités chimiques du corps forment un ensemble compact et désordonné c’est à dire qu’elles sont en contact les unes avec les autres et sont orientées sans suivre d’ordre particulier.
- comparer la température du corps à sa température de solidification (ou de fusion) et à sa température d’ébullition.
Si la température du corps est comprise entre sa température de solidification et sa température d’ébullition alors ce corps est à l’état liquide.
- procéder par élimination
Si un corps n’est ni solide ni gazeux alors il est nécessairement liquide.
Quelques corps à l’état liquide dans les conditions usuelles
Leur définition peut varier mais on considère en général que les conditions usuelles correspond à la pression atmosphérique moyenne (101325 Pa) et à une température de 20°C
Dans ces condition voici quelques corps purs liquides:
Métaux
- Mercure (Hg)
Halogènes
- Dibrome (Br2)
Alcanes
- Pentane
- Hexane
- Heptane
- Octane
- Nonane
- Décane
- Undécane
- Dodécane
- Tridecane
- Tetradécane
- Pentadécane
- Hexadécane
- Cyclopentane
- Cyclohexane
- Cycloheptane
- Cyclooctane
- Cyclononae
- Cyclodécane
Alcools
- Methanol
- Ethanol
- Propan-1-ol
- Butan-1-ol
- Pentan-1-ol
- Hexan-1-ol
- Heptan-1-ol
- Octan-1-ol
- Nonan-1-ol
- Décan-1-ol
Autres espèces chimiques organiques
- Tetrachlorométhane (CCl4)
Espèces chimiques minérales
- Eau (H2O)
Document 1 – source NASA
Document 2: illustration originale
Document 3: Source – Libretext.org – C BY-NC-SA 3.0
