Cours de chimie niveau seconde –2. Modélisation des transformations de la matière et transfert d’énergie– B) Transformations physiques
- Caractéristiques de l’état solide (rappel)
- Description microscopique de l’état solide
- Transformations physiques possibles pour un solide
- Effet d’un échange d’énergie thermique sur un solide
Caractéristiques de l’état solide (rappel)
Un solide possède une forme propre et un volume propre:
- Il dispose d’une forme “stable” qui ne change pas sauf si on le soumet à des contraintes
- Son volume (en l’absence de perte de matière) reste le même (il est incompressible)
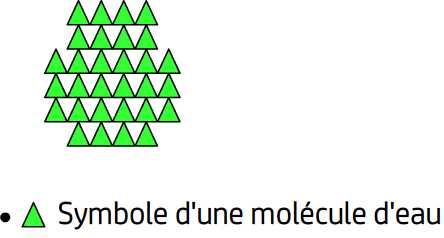
Description microscopique de l’état solide
Un solide est composé d’entités chimiques qui peuvent être:
- des atomes (par exemple les métaux, le graphite)
- des molécules (par exemple la glace, le saccharose)
- des ions (par exemple le chlorure de sodium, sulfate de cuivre)
Les entités chimiques qui constituent un solide possèdent chacune une place bien précise au sein de ce solide, elles ne peuvent pas avoir de mouvement de translation et occupent une position moyenne qui ne varie pas.
En raison d’une localisation et d’une orientation bien précise des entités chimiques dans les solides on dit que l’état solide est un état ordonné.
C’est le seul état de la matière ayant cette caractéristique, les autres états (liquide et gazeux) sont désordonnés.
Le seul mouvement que peuvent avoir les entités d’un solide est un mouvement de vibration: elles peuvent faire des va et vient autour de leur position d’équilibre avec une vitesse et une amplitude qui dépend de la température.
Par ailleurs les entités chimiques d’un solide sont proches les unes des autres, l’espace vide qui subsiste est réduit au minimum et pour cette raison on dit que l’état solide est un état compact.
Une conséquence de cette organisation est une densité minimale pour l’état solide, il n’existe qu’un nombre très limité d’exceptions (parmi lesquelles l’eau) où l’état solide est moins dense que l’état liquide.
Remarque: il ne s’agit pas d’une caractéristique propre à l’état solide, l’état liquide est aussi compact même si sa densité est en général légèrement plus élevée.
On retient donc que l’état solide est un état compact et ordonné.
Transformations physiques possibles pour un solide
- Un solide peut subir un échauffement ou un refroidissement c’est à dire une élévation ou une baisse de température:
Un solide qui reçoit de l’énergie thermique peut subir une hausse de température, les vibrations de ses entités chimiques s’accentuent.
Un solide qui cède de l’énergie thermique peut subit une baisse de température, les vibrations des entités chimique diminuent.
- Un solide peut subir une fusion c’est à dire un changement d’état qui le conduit à l’état liquide. Cette transformation physique peut survenir lorsque le solide se trouve à une température maximale appelée température de fusion. L’énergie thermique qu’il reçoit dans ces condition permet aux entités chimiques d’acquérir une énergie suffisante pour vaincre les interactions attractives qui les maintenaient initialement fixes.
- Un solide peut aussi subir une dissolution: au contact d’un solvant (comme l’eau) les entités chimiques du solide se dispersent parmi les entités qui constituent le liquide;
Effet d’un échange d’énergie thermique sur un solide
- Si un solide cède de l’énergie thermique alors il se refroidit, sa température diminue.
- Si un solide reçoit de l’énergie thermique et que sa température est inférieure à sa température de fusion il se réchauffe, sa température augmente.
- Si solide reçoit de l’énergie thermique alors qu’il est à sa température de fusion alors il change d’état et devient liquide.
