- Autres noms
- Catégorie d’ion
- Représentation et notation
- Composition
- Formation de l’ion hydrogène
- Taille de l’ion hydrogène
- Configuration électronique
- L’ion hydrogène en solution aqueuse
- L’ion hydrure
- Détecter les ions hydrogène H+
- Les sources d’ion hydrogène
- Ion hydrogène et réactions acide-base
- Oxydoréduction
Autres noms
L’ion hydrogène est aussi appelé
- “ion Hydron”
- ou simplement “Proton“
- On peut aussi préciser “Cation” hydrogène” pour éviter toute confusion avec l’ion hydrure (H–) qui est un anion
Catégorie d’ion
L’ion hydrogène présente un défaut d’électron et par conséquent les charges positives y sont majoritaires. Il s’agit donc d’un ion positif: un cation
Représentation et notation

- Formule développée et semi-développée: l’ion hydrogène est une espèce monoatomique qui ne comporte pas de liaison chimique par conséquent il n’y a pas lieu de lui attribuer une formule développée ou semi-développée.
- Schéma de Lewis:
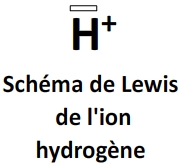
Composition
L’ion hydrogène est un ion monoatomique ayant un défaut d’un électron, c’est à dire qu’il possède un électron de moins que l’atome d’hydrogène. Par conséquent l’ion hydrogène ne possède donc plus aucun électron! En ce qui concerne le noyau, son isotope le plus courant ne comporte qu’un proton et aucun neutron.
L’isotope le plus courant de l’hydrogène forme un ion composé d’un seul proton (pas d’électron ni de proton)
Formation de l’ion hydrogène
Il peut se former lorsque qu’un atome d’hydrogène (H) perd un électron.
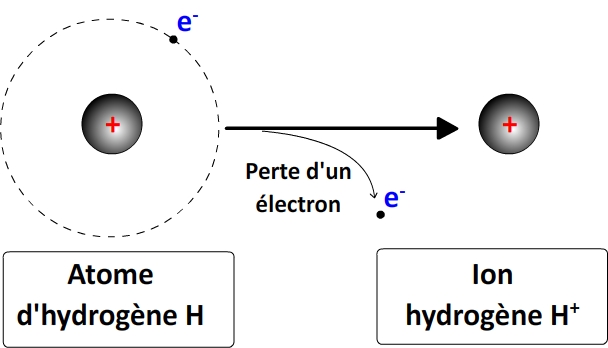
cette perte d’électron peut avoir lieu lors d’une transformation chimique ou physique.
Un atome d’hydrogène peut être ionisé (perdre son unique électron) lorsqu’il est exposé à un rayonnement suffisamment énergétique. L’énergie d’ionisation d’un atome d’hydrogène est Ei = 13,6 eV soit 2,18.10-18 J.
L’énergie d’un photon est exprimée grâce la relation:
E = h.ν
étant donné que 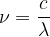 :
:
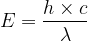
La longueur d’onde maximale d’un rayonnement capable d’ioniser un atome d’hydrogène est donc:
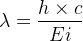
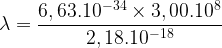
λ = 9,12.10-8 m
λ = 91,2 nm
Les rayonnements de longueur d’onde supérieure à 9,12 nm (c’est à dire les ultraviolets les plus énergétiques, les rayons X et les rayons gamma peuvent ioniser les atomes d’hyrdrogène.
Les ions H+ peuvent être produits lors de l’oxydation d’une molécule de dihydrogène (H2). Ils sont aussi échangés lors d’une réaction acide-base.
Taille de l’ion hydrogène
La composition de l’ion hydrogène (pas d’électron et seulement un proton dans son noyau) en fait le plus des ions (Son rayon est d’environ 1,5.10-15 m).
Configuration électronique
Etant donné que l’ion hydrogène ne possède aucun électron sa configuration électronique se limite exceptionnellement à une sous couche 1s vide: 1s0
L’ion hydrogène en solution aqueuse
Il n’y existe pas sous forme libre, il se combine toujours à une molécule d’eau pour former un ion hydronium de formule H3O+ suivant la demi-équation:
H+ + H2O → H3O+
L’ion hydrure
l’hydrogène peut aussi former un autre ion, l’anion hydrure, de formule H– qui possède un excès d’un électron et qui n’est pas stable en solution aqueuse. Une confusion avec H+ et peu probable car le terme “ion hydrogène” est en général réservé à H+
Détecter les ions hydrogène H+
- Détection chimique
En solution aqueuse la présence d’un ion hydrogène peut se faire par simple mesure du pH (papier pH, pH-mètre). Un pH inférieur à 7 indique que la solution est acide et qu’elle comporte des ions hydrogène (combinés aux molécules d’eau sous forme d’ion oxonium H3O+) ne provenant pas uniquement de la simple auto-protolyse de l’eau.
Par ailleurs, lorsque la concentration des ions hydrogène est suffisante, leur mise en évidence peut se faire en exploitant leur réactivité chimique. Les ions hydrogène peuvent oxyder certain métaux (fer, le zinc, l’aluminium, le plomb..) en formant du dihydrogène.
Si l’on mélange une poudre métallique (fer, zinc, plomb, aluminum) et qu’il se forme des bulles d’un gaz qu’on peut identifier comme du dihydrogène H2 alors on peut en conclure que cette solution est aciden et qu’elle contient des ions hydrogène.
Détection physique
La détection physique des ions hydrogène est délicate car en l’absence de d’électron ils ne présentent pas de raie d’absorption ni de raie d’émission (qui sont liées à des transitions électroniques entre les différents niveau d’énergie de l’atome) par conséquent la spectroscopie classique (UV, visible ou IR) ne permet pas de détecter ces ions.
Les sources d’ion hydrogène
Les ions hydrogène sont présents (sous forme d’ions oxonium H3O+) dans toutes les solutions aqueuses y compris les solutions basiques. Ils résultent de l’autoprotolyse de l’eau, c’est à dire de la réaction acide-base entre deux molécules d’eau conduisant à la formation d’un ion oxonium et d’un ion hydroxyde:
2H2O ⇆ H3O+ + OH–
- L’ionosphère
La partie supérieure de l’atmosphère terrestre (appelée ionosphère) est composée d’ions gazeux. La zone la plus externe de l’ionosphère est composée (entre autres) d’ion hydrogène H+.
- Les étoiles
Le constituant majoritaire des étoile est l’hydrogène qui, en raison de la température, est totalement ionisé et se présente donc sous forme d’ion hydrogène.
- Les nébuleuses
Elles sont essentiellement constituées d’hydrogène ionisé sous l’effet des rayonnements, cet hydrogène se présente donc sous forme d’ion H+.
L’hydrogène est l’élément le plus abondant à l’échelle de l’Univers et ce dernier se présente essentiellement sous forme ionique par conséquent:
L’ion hydrogène est l’espèce chimique la plus abondante de l’Univers!
Ion hydrogène et réactions acide-base
l’ion hydrogène est l’ion échangé lors d’une réaction acide base: il est transféré de l’acide d’un premier couple à la base d’un deuxième couple. Une espèce chimique acide a toujours une formule de la forme A1H et cède un ion hydrogène pour former sa base conjuguée suivant une demi-équation de la forme:
A1H = A1– + H+
Au contraire une espèce chimique basique de la forme A2– peut capter un ion hydrogène pour former son acide conjuguée A2H suivant une demi-équation ayant la forme suivante:
A1– + H+ = A1H
Une réaction acide base est donc toujours décrite par une équation de la forme:
A1H + A2– ⇌ A1– + A2H
Oxydoréduction
L’ion hydrogène H+ est la forme oxydante du couple H+/H2 de potentiel standard E°= 0 V
La demi-équation d’oxydoréduction du couple est:
2H+ + 2e– ⇌ H2
En solution aqueuse l’ion hydrogène est susceptible d’oxyder de nombreux métaux comme par exemple:
- Le fer Fe + 2H+ → Fe2+ + H2
- L’aluminium 2Al + 6H+ → 2Al3+ + 3H2
- Le zinc Zn + 2H+ → Zn2+ + H2
