Cours de physique – niveau classe de première S – partie « Lois et modèles – Cohésion et transformations de la matière »
- Définition
- Comment vérifier qu’une molécule est apolaire ?
- Comment prouver qu’une molécule est apolaire malgré des liaisons polarisées ?
- Comment savoir si une molécule est polaire ?
- Influence de la polarisation sur les changements d’état
- Solvant polaires et apolaires
Définition
Si le moment dipolaire d’une molécule est non nul alors cette molécule est dite polaire.
Si le moment dipolaire d’une molécule est nul alors cette molécule est apolaire.
Remarque
Une liaison dispose d’un moment dipolaire si elle est polarisée et que les atomes liés portent des charges partielles (négative pour le plus électronégatif et positive pour le moins électronégatif). Dans le cas d’une molécule polaire la situation est comparable puisque le centre (ou plus précisément le barycentre) des charges partielles positives ne coïncide pas avec celui des charges partielles négatives.
Comment vérifier qu’une molécule est apolaire ?
- Cas n 1: corps simple
Si la molécule n’a qu’une seule sorte d’éléments (il s’agit d’un corps simple) alors aucune de ses liaisons n’est polarisée et elle est nécessairement apolaire.
Exemples
Le dioxygène O2, le diazote N2, le dichlore Cl2
- Cas n 2: liaisons non polarisées
Si une molécule est composée d’éléments dont les différences d’électronégativité sont trop faible alors aucune de ses liaisons n’est polarisée et elle est elle-même apolaire.
C’est en particulier le cas des hydrocarbures constitués uniquement de carbone et d’hydrogène.
Exemples
Le méthane CH4, l’ethène (acétylène) C2H4
- Cas n°3 les polarisations se compensent
Si une molécule comporte des liaisons polarisées elle peut tout de même être apolaire si les différentes polarisations se compensent, ce qui implique la présence d’au moins deux liaisons polarisées.
Comment prouver qu’une molécule est apolaire malgré des liaisons polarisées ?
Il est possible de prouver que les polarisations se compensent de trois manières différentes :
- Méthode 1: en montrant que la somme des vecteurs moments dipolaires est nulle.
Exemple du dioxyde de carbone CO2

- Méthode 2: en montrant que le centre des charges partielles positives coïncide avec le centre des charges partielles négatives
Exemple du dioxyde de carbone CO2
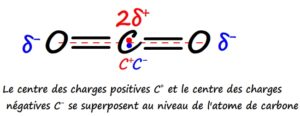
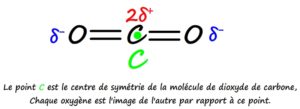
- Méthode 3: en montrant que la molécule dispose d’un centre de symétrie (chaque atome est l’image d’un autre atome par symétrie centrale) car cette symétrie implique que les centre des charges partielles positives soit situé au même point que le centre des charges partielles négatives.
Exemple du dioxyde de carbone CO2
Comment savoir si une molécule est polaire ?
Une molécule ne peut être polaire que si elle comporte au moins une liaison polarisée.
Si une molécule ne comporte qu’une seule liaison polarisée alors la molécule est nécessairement polaire
Si une molécule comporte au moins deux liaisons polarisées alors la molécule n’est polaire qu’à condition que ces polarisations ne se compensent pas.
Pour déterminer si c’est bien le cas on peut:
- faire la somme des vecteurs moments dipolaires de toutes les liaisons polarisées et vérifier que la résultante est un vecteur non nul
- chercher le centre géométrique des charges partielles positives d’une part et celui des charges partielles négatives d’autre part puis vérifier que ces centres ne sont pas localisés au même point.
Influence de la polarisation sur les changements d’état.
Si un corps pur est constitué de molécules polaires alors elles exercent entres elles des interactions électriques globalement attractives:
- Les pôles positifs attirent les pôles négatifs et ces interactions sont d’autant plus intenses que la polarisation est forte.
- Ce sont ces interactions attractives qui imposent une place fixe aux molécules à l’état solides et les maintiennent en contact dans l’état liquide.
Pour passer de l’état solide à l’état liquide puis de l’état liquide à l’état gazeux, l’énergie thermique des molécules doit être suffisante pour vaincre ces interactions par conséquent la règle générale est que: Plus la polarisation des molécules d’un corps pur est importantes plus les températures de fusion et d’ébullition sont élevées.
Exemple
Le méthane, le chlorométhane et le dichlorométhane possèdent une polarisation croissante:
- Le méthane (CH4) est apolaire
- La molécule de chlorométhane (CH3Cl) est polaire car elle comporte une liaison polarisée carbone-chlore
- La molécule de dichlorométhane (CH2Cl2) est davantage polaire que le chlorométhane car la polarisation des deux liaison carbone-chlore s’additionnent.
Leur température d’ébulition est aussi croissante:
- Teb = -131,5°C pour le méthane
- Teb = -24,2°C pour le chlorométhane
- Teb = 39,6°C pour le dichloromethane
Solvant polaires et apolaires
On distingue les solvants polaires (constitués de molécules polaires) des solvants apolaires (constitués de molécules apolaires.
Un solvant, pour remplir son rôle, doit pouvoir “briser” la cohérence des solutés et disperser ces derniers. Cette aptitude dépend de sa polarité :
Les solvants polaires sont en général capables de dissoudre les solutés ioniques ainsi que les solutés moléculaires polaires tandis que les solvant apolaires dissolvent surtout des solutés moléculaires apolaires.
Notions de seconde à réviser
- L’atome
- Les électrons
- La charge électrique
- Les éléments chimiques
- Les couches électroniques
- Structure électronique
- Règles du duet et de l’octet
- Le tableau périodique
