- Le tableau de Mendeleiv
- Le tableau périodique moderne
- Les périodes
- Les groupes
- Propriétés chimiques communes aux éléments d’un même groupe
- Les familles d’éléments chimiques
Le tableau de Mendeleiv
Au début du XVIIIème siècle les différentes découvertes dans le domaines de la chimie amènent John Dalton à développer une théorique atomique qui s’impose progressivement. Selon cette dernière la matière est composée de particules élémentaires (des “éléments”) baptisées “atomes”.
En 1869 le chimiste russe Dimitri Mendeleïev propose un tableau où les différents atomes connus sont classés suivant différentes caractéristiques physiques et chimiques. Mendeleïev n’est pas le premier à proposer un classement des atomes mais les critères choisis sont remarquablement pertinents et font de son tableau un outil prédictif étonnamment efficace.
En effet, à l’époque où Mendeleïev réalise cette classification:
- Les connaissances sur la structure de l’atome sont limitées, il est toujours considéré comme une particule élémentaire (et ce jusqu’à 1897, lorsque Joseph Thomson découvre l’existence des atomes).
- La notion d’élément est beaucoup plus .. élémentaire ! La distinctions entre éléments est empirique (repose sur des données expérimentales) et n’a pas de base théorique puisque le noyau atomique ainsi que les nucléons n’ont pas encore étés découverts
- De nombreux éléments (plusieurs dizaines) ne sont tout simplement pas encore connus.
La classification de Mendeleïev reposes sur deux règles principales:
- Les atomes sont classés sur une même ligne par masse atomique croissante
- Les atomes ayant des propriétés chimiques analogues, et en particulier la même valence (formant le même nombre de liaisons), sont placés dans une même colonne.
Mendeleïev se contraint à respecter systématiquement ces deux règles ce qui l’amène à proposer un tableau comportant de nombreuses cases vides. Loin d’être un défaut, ces “trous” constituent l’un des atout du tableau de Mendeleïev: ils permettent de prévoir l’existence d’éléments chimiques encore inconnus et d’estimer leur masse atomiques ainsi que leurs probables propriétés chimiques.

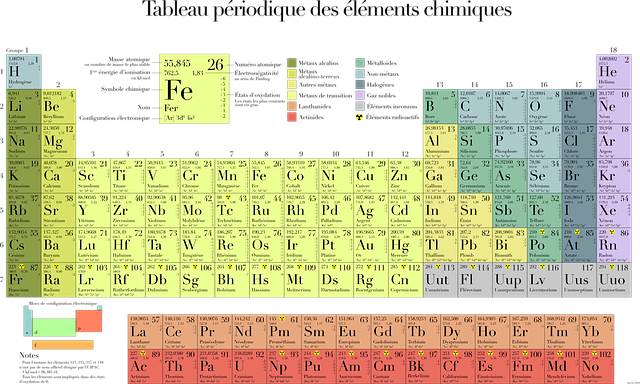
Le tableau périodique moderne
Il est l’héritier du tableau de Mendeleïev, et comporte de nombreuse similarités cependant les critères de classement ont été adaptés aux connaissances actuelles de la matière: il se réfère à la structure du noyau atomique et à la structure électronique.
Chaque case contient au minimum les informations suivantes:
- Le symbole chimique (H, He, Li etc) accompagné du nom de l’élément
- Le numéro atomique Z
Il est rare qu’un tableau se limite à ces deux informations mais il arrive qu’une version aussi simplifiée soit utilisée au collège.
Les classifications périodiques le plus courantes comportent aussi une troisième information qui est le nombre de nucléons. Etant donné que chaque élément présente plusieurs isotopes (avec des nombres de neutrons différents) il s’agit d’une moyenne du nombre de nucléons présent dans les différents isotope d’un échantillon naturel de cet élément. Ce nombre de nucléons, aussi appelé nombre de masse correspond aussi à la masse molaire de l’élément exprimée en g/mol.
Il arrive parfois que certains tableaux périodiques fournissent des données supplémentaires pour chaque élément comme l’électronégativité, la configuration électronique, l’énergie de première ionisation, les différents états d’oxydation.
Les périodes
Définition: une période correspond à l’une des ligne du tableau périodique
Le tableau comporte 7 périodes différentes numérotées de 1 à 7:
– La période 1 comporte 2 l’hydrogène et l’hélium
– La période 2 comporte le lithium, le béryllium, le bore, le carbone, l’azote, l’oxygène, le fluor et le néon
– La période 3 comporte le sodium, le magnésium, l’aluminium, le silicium, le phosphore, le soufre, le chlore et le l’argon
etc
Critères de classement des éléments d’une période:
- les éléments sont placés de gauche à droite selon un numéro atomique Z croissant
- chaque changement de période correspond au remplissage d’une nouvelle couche électronique.
Par conséquent:
- Sur une même ligne, de gauche à droite, les éléments ont un numéro atomique de plus en plus grand mais aussi un nombre croissant de nucléons ainsi qu’une masse molaire atomique de plus en plus grande.
- Les formes atomiques des éléments d’une même ligne ont tous la même couche externe, sur la première ligne la couche externe est K, sur la deuxième ligne la couche externe est L, sur la troisième ligne la couche externe est M etc…
Le long d’une même période les propriété chimico-physiques ont tendance à évoluer de manière linéaire, par exemple:
- La masse molaire atomique est croissante
- Le rayon atomique moyen est décroissant
- L’électronégativité (notion au programme de premières S) est croissante
Les groupes
Définition: un groupe d’élément correspond à une colonne du tableau périodique
Attention, il y a parfois confusion entre la notion de groupe et celle de famille, il arrive parfois qu’une famille se limite à un groupe mais la réciproque n’est pas toujours vraie.
Le tableau compte un total de 18 groupes différents numérotés de 1 à 18 mais qui peut être désigné à partir de son premier membre:
- Le groupe 1 (groupe de l’hydrogène) comporte l’hydrogène, le lithium, le sodium, le potassium, le rubidium, le césium et le francium
- Le groupe 2 (groupe du béryllium) comporte le béryllium, le magnésium, le calcium, le strontium, le baryum et le radium
- Le groupe 3 comporte le scandium, l’yttrium, le lanthane et l’actinium.
- etc
Critère de classement des éléments d’un groupe:
- Ils ont tous le même nombre d’électrons sur leur couche externe.
- Le long d’une colonne (de haut en bas) le les éléments ont un nombre total de couches électroniques croissant.
Par conséquent:
- Tous les éléments du premier groupe ont le même nombre d’électrons sur leur couche externe
- Tous les éléments du deuxième groupe ont le même nombre d’électrons sur leur couche externe
- etc
Pour certains groupe ce nombre peut facilement être déterminé:
- Groupe 1: 1 électron
- Groupe 2: 2 électrons
- Groupe 2: 2 électrons
- Groupe 13: 3 électrons
- Groupe 14: 4 électrons
- Groupe 15: 5 électrons
- Groupe 16: 6 électrons
- Groupe 17: 7 électrons
- Groupe 18: 8 électrons
Propriétés chimiques communes aux éléments d’un même groupe
Les propriétés chimique d’un élément dépendent essentiellement de sa couche externe, ce sont les électrons de cette couche qui conditionnent sa réactivité.
Justement, les éléments d’un même groupe ont le même nombre d’électrons sur leur couche externe par conséquent ils présentent des propriétés et des réactivités analogue en particulier en ce qui concerne la formation des ions et des liaisons covalentes
Formation d’ions
Les éléments d’un même groupe forment des ion de même nature (cation ou anion) présentant le même défaut ou le même excès d’électrons, en particulier:
- Les éléments du groupe 1 (famille des alcalins) forment des cations portant une charge positive excédentaire (H+, Li+, Na+, K+ etc)
- Les éléments du deuxième groupe (famille des alcalinos-terreux) forment des cations ayant une charge excédentaire positive (Be2+, Mg2+, Ca2+ etc)
- Les éléments de l’avant dernier groupe (famille des halogène) forment des anions portant une charge excédentaire négative (F–, Cl–, Br–, I– etc)
Liaisons covalentes
Les éléments d’un même groupe forment le même nombre de liaison covalent, en particulier:
- Aucune pour les éléments du dernier groupe (famille des gaz nobles)
- Une seule pour éléments de l’avant-dernière colonne (groupe 17, famille des halogènes)
- Deux pour les éléments du groupe 16 (oxygène, soufre, sélénium etc)
- Trois pour les éléments du groupe 15 (azote, phosphore, astate etc)
- Quatre pour les éléments du groupe 14 (Carbone, silicium)
Les familles d’éléments chimiques
Le tableau périodiques a été divisé en familles qui regroupent des éléments ayant des propriétés physico-chimiques proches. On distingue traditionnellement les familles suivantes:
- Les alcalins (éléments de la première colonne à l’exception de l’hydrogène)
- Les alcalino-terreux (éléments de la deuxième colonne)
- Les métaux
- Les métaux de transition (bloc central du tableau)
- Les métalloïdes
- Les halogènes (avant-dernière colonne)
- Les gaz rares aussi appelés gaz nobles (dernière colonne)
- Les lanthanides (éléments de Z=57 à Z = 71, notés sous la partie principale du tableau)
- Les actinides (éléments 89 à 103, notés sous la partie principale du tableau)
- Les non-métaux