Cours de physique-chimie | première spécialité
Ce cours correspond à la partie “De la structure à la polarité d’une entité” du programme de première spécialité.
Il est situé dans la partie du programme “Constitution et transformations de la matière – De la structure des entités aux propriétés physiques de la matière”
- Schéma de Lewis: définition
- Schéma de Lewis: règles de représentation
- Quelques exemples de schéma de Lewis
- Lacune électronique
- A quoi le schéma de Lewis sert-il ?
- Comment trouver le schéma de Lewis d’une entité chimique ?
- Trouver le schéma de Lewis d’une molécule à partir de ses éléments chimiques
- Trouver le schéma de Lewis d’une molécule à partir de sa formule développée
- Exemple de schémas de Lewis pour des molécules
- Trouver le schéma de Lewis d’un cation polyatomique
- Exemples de schémas de Lewis pour des cations polyatomiques
- Trouver le schéma de Lewis d’un anion polyatomique
- Exemples de schéma de Lewis d’anions polyatomiques
- Trouver la géométrie d’une molécule à partir de son schéma de Lewis
- Les principales géométries
- Tableau: résumé des différentes géométries moléculaires
Electronégativité, liaisons polarisées et molécules polaires
- Electronégativité
- Valeurs de l’électronégativité pour les éléments les plus courants
- Variation de l’électronégativité dans le tableau périodique
- Liaisons polarisées et non polarisées
- Charges partielles
- Exemple de liaison polarisée: la liaison carbone – oxygène
- Quelques exemples de liaisons non polarisées
- Qu’est-ce qu’une molécule polaire ?
- Quelques exemples de molécules polaires.
- Qu’est-ce qu’une molécule apolaire ?
- Méthode pour déterminer si une molécule est polaire
A réviser – Les autres cours de première spécialité – Pour approfondir et découvrir
Le schéma de Lewis
Schéma de Lewis: définition
Le schéma de Lewis est aussi appelé “formule de Lewis”, il correspond à la représentation d’une entité chimique (molécule ou ion polyatomique) où apparaissent tous les doublets d’électrons (liants ou non liants) de la couche de valence.
Schéma de Lewis: règles de représentation
Le schéma de Lewis s’établit en respectant les règles suivantes:
- Chaque élément est représenté par son symbole atomique (Le carbone par “C”, l’azote par “N”, le chlore par Cl etc…)
- Chaque doublet liant (liaison de covalence) est représenté en suivant les mêmes règles que dans les formules développées ou semi-développées. Deux atomes partageant un doublet liant (liés par une liaison simple) sont reliés par un trait, s’ils partagent deux doublets liants (double liaison) ils sont reliés par un double trait (deux traits parallèles entre les symboles atomiques) s’ils partagent trois doublets liants (triple liaison) ils sont reliés par un triple trait (trois traits parallèles entre les deux symboles chimiques)

- chaque doublet non liant est représenté par un trait situé autour du symbole atomique
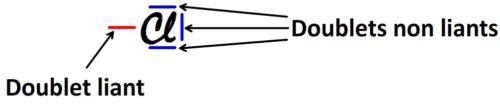
Quelques exemples de schéma de Lewis
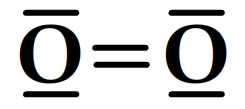
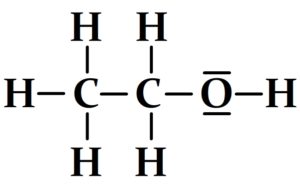
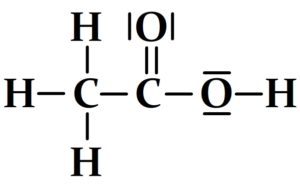
Lacune électronique
On dit qu’un élément possède une lacune électronique si sa couche de valence n’est pas pleine et qu’il lui manque des doublets d’électrons pour suivre la règle du duet ou de l’octet.
Chaque lacune électronique correspond à un doublet d’électrons manquant sur sa couche externe, elle est symbolisée par un “rectangle vide”.
La plupart des éléments possèdent une ou des lacunes électroniques lorsqu’il sont sous leur forme atomique isolée mais il la perde lorsqu’ils forment des ions ou des molécules. Il existe cependant quelques exceptions, certains éléments gardent une lacune électronique même sous forme d’ion ou de molécule.
L’exemple de lacune électronique le plus courant est celui de l’ion hydrogène H+ qui possède une couche 1s vide (il n’a plus aucun électron). On peut donc le symboliser de la manière suivante:
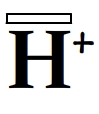
et sa lacune électronique
A quoi le schéma de Lewis sert-il ?
Tout comme une formule développée (ou semi-développée), le schéma de Lewis permet de représenter la structure d’une entité chimique, elle indique l’enchaînement des atomes et permet d’identifier rapidement les groupes fonctionnels (hydroxyle, carboxyle…)
Par ailleurs la représentation des doublets non liants apporte une utilité supplémentaire:
Elle permet de prévoir la répartition spatiale des doublets liants et non liants autour d’un noyau puis d’en déduire la géométrie adoptée par les atomes et groupements d’atomes liés à un atome central (voir paragraphe suivant de ce cours)
Comment trouver le schéma de Lewis d’une entité chimique ?
Pour établir un schéma de Lewis correct il faut bien entendu respecter les règles de représentation déjà précisées juste avant mais il faut aussi respecter les règles de stabilité déjà vues en classe de seconde: la règle du duet et de l’octet.
Si un atome forme un ion (en gagnant ou perdant des électrons) ou s’il forme des liaisons covalentes (en gagnant un électron “partagé” pour chaque liaison formée) c’est toujours dans le but d’aller vers une plus grande stabilité et cette dernière s’obtient avec une couche de valence totalement remplie.
Par conséquent:
L’hydrogène (H) suit la règle du duet et s’entoure d’un doublet liant lorsqu’il forme une molécule mais lorsqu’il forme un ion alors il présente une exception à loi du duet et possède une lacune électronique.
Le lithium et le magnésium suivent aussi la règle du duet mais forment principalement des cations.
Les gaz nobles (dans la dernière colonne du tableau) suivent tous la règle de l’octet (sauf l’hélium qui suit celle du duet) sous leur forme atomique. Ils ne se lient pas et ne figurent donc jamais dans le schéma de Lewis d’une molécule ou d’un ion.
Les autres éléments (avec quelque exceptions) suivent la règle de l’octet: ils s’entourent tous d’un total de 4 doublets d’électrons (liants ou non liants)
Trouver le schéma de Lewis d’une molécule à partir de ses éléments chimiques
Si l’on souhaite trouver le schéma de Lewis d’une molécule alors on peut facilement identifier les doublets liants et non liants qui entourent un atome.
D’après les règles vues dans le paragraphe précédent la plupart des éléments s’entourent d’un total de 4 doublets d’électrons, il reste cependant à déterminer lesquels sont liants et lesquels sont non liants.
Dans le cas d’une molécule les choses sont assez simples:
le nombre de doublets liants correspond au nombre d’électrons manquant pour remplir la couche de valence (en général cela revient à compléter la dernière sous-couche “p” pour atteindre p6) et les doublets restants sont non liants.
Par conséquent, un atome:
- dont la dernière sous-couche est p2 (élément de la deuxième colonne du bloc p du tableau couche s2p2) forme 4 doublets liants et n’a pas de doublet non liant.
- dont la dernière sous-couche est p3 (élément de la troisième colonne du bloc p du tableau couche s2p3) forme 3 doublets liants et a donc un doublet non liant.
- dont la dernière sous-couche est p4 (élément de la quatrième colonne du bloc p du tableau couche s2p4) forme 2 doublets liants et a donc 2 doublets non liants.
- dont la dernière sous-couche est p5 (couche s2p5)forme 1 doublet non liant et a donc 3 doublets non liants.
Chaque élément aura toujours l’une des représentations suivantes dans un schéma de Lewis.
- L’atome d’hydrogène
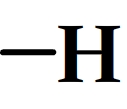
Pas de différence avec l’hydrogène représenté dans une formule développée.
- L’atome de carbone
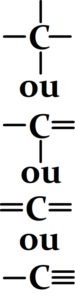
Carbone avec quatre doublets liant et aucun doublet liant.
- L’atome d’azote
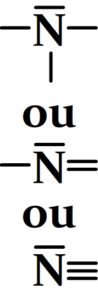
Azote avec trois doublets liants et un doublet liant.
- L’atome d’oxygène
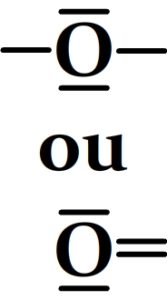
Atome d’oxygène avec deux liaisons doublets liants et deux doublets non liants.
- L’atome de fluor (F)
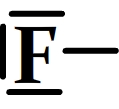
Atome de fluor avec une liaison simple et trois doublets non liants.
Trouver le schéma de Lewis d’une molécule à partir de sa formule développée
La méthode pour transformer la formule développée d’une molécule en schéma de Lewis est relativement simple:
- les hydrogène ne subissent aucune modification (ils n’ont pas de doublet non liant et leur représentation est la même)
- les atomes formant 4 liaisons (possédant 4 doublets liants) restent inchangés ( s’ils ont 4 doublets liants alors il ne peuvent pas avoir de doublet non liant)
- pour les autres atomes on ajoute autant de doublets non liants que nécessaire pour arriver à un total de 4 doublets ( un atome formant 3 liaisons a donc un doublet non liant, un atome avec deux liaisons aura deux doublets non liants et un atome formant une seule liaison aura trois doublets non liants).
Exemples
- Ethanol
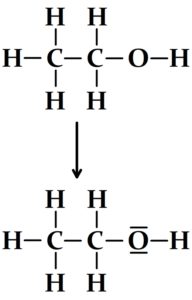
Pour passer de la formule développée au schéma de Lewis on ajoute les deux doublets non liants de l’oxygène
- Chlorure d’ethanoyle
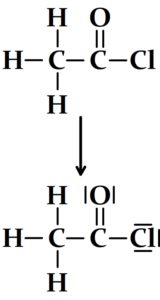
Pour passer de la formule développée au schéma de Lewis on ajoute les trois doublets non liants du chlore et les deux de l’oxygène
Exemple de schémas de Lewis pour des molécules
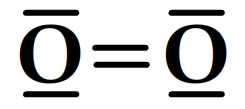
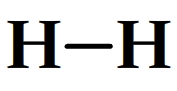
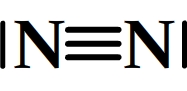
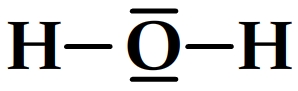
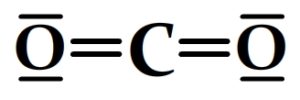
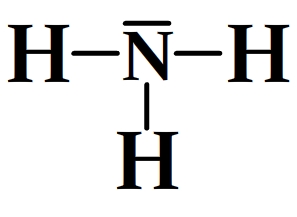
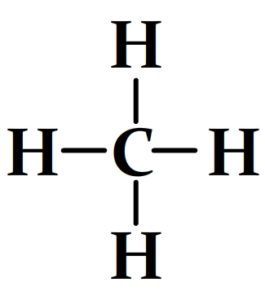
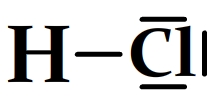
Trouver le schéma de Lewis d’un cation polyatomique
Dans un cation polyatomique un élément perd un électron provenant d’un de ses doublets non liants et forme un doublet liant avec un autre atome. Ainsi cet élément:
- porte une charge excédentaire positive
- respecte tout de même la loi de l’octet et s’entoure de 4 doublets liants.
Par conséquent seul un atome possédant initialement au moins un doublet liant peut porter la charge positive d’un cation polyatomique.
Il est par exemple possible d’avoir un cation polyatomique comprenant de l’oxygène (deux doublets non liants) ou de l’azote (un doublet non liant).
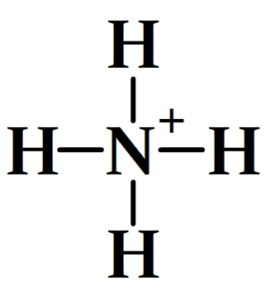
- La charge positive est portée par un azote
Dans le cas d’un cation polyatomique où l’azote porte une charge positive alors il perd son doublet liant possède une liaison supplémentaire, il sera représenté de la manière suivante dans un schéma de Lewis:
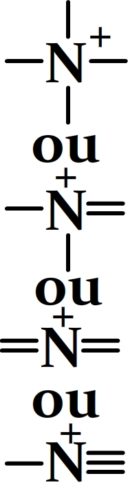
- La charge positive est portée par un oxygène
Dans le cas où l’oxygène porte une charge positive alors il perd l’un de ses doublets non liants (il ne lui en reste qu’un) et forme une liaison supplémentaire (il a alors trois doublets liants) et l’on obtient le schéma de Lewis suivant:
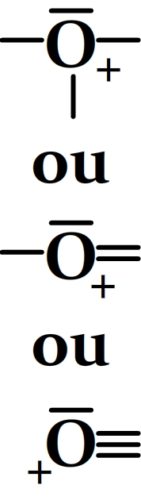
Exemples de schémas de Lewis pour des cations polyatomiques
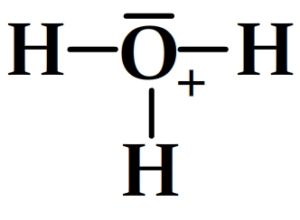
Trouver le schéma de Lewis d’un anion polyatomique
Dans un anion monoatomique un élément a rompu l’une de ses liaisons et l’électron solitaire qui n’est plus partagé forme un doublet non liant avec un électron supplémentaire gagné. Ainsi, cet élément:
- porte une charge excédentaire négative.
- respecte toujours la règle de l’octet puisque le doublet liant perdu est remplacé par un doublet non liant.
Par exemple, dans le cas de l’oxygène, celui-ci a perdu l’un de ses doublets liants (il ne lui en reste qu’un) mais il a un doublet non liant supplémentaire (il en trois au total) et se représente de la manière suivante dans un schéma de Lewis:
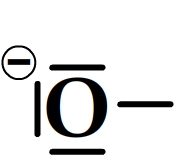
Exemples de schéma de Lewis d’anions polyatomiques
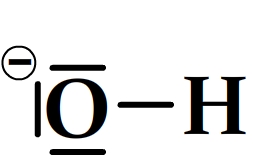
Géométrie des molécules
Trouver la géométrie d’une molécule à partir de son schéma de Lewis
Le schéma de Lewis permet de prévoir la géométrie des petites molécules ainsi que la répartition spatiale des groupements autour d’un atome central.
Pour cela on exploite une hypothèse simple: les doublets liants d’un atome (simples, doubles ou triples) ainsi que ses doublets non liants se repoussent tous entre eux en raison de la force électrostatique. En effets les électrons sont négatifs et tous les doublets qu’ils constituent sont aussi négatifs donc il s’exerce entre eux des forces électriques répulsives.
Par conséquent la configuration la plus stable est celle où les doublets sont tous éloignés au maximum les uns des autres.
A partir du nombre de liaisons et de doublets non liants autour d’un atome il est alors possible de déduire leur direction et d’en tirer la répartition spatiale des groupements chimiques autour d’un atome centrale
Voir cours “La géométrie des molécules“
Les principales géométries
Les différentes combinaisons de doublets non liants, de liaisons covalentes simples doubles ou triples permettent de prévoir la géométrie d’une molécule autour d’un atome central.
- Quatre liaisons simples et aucun doublet non liant: Géométrie tétraédrique
Chaque atome ou groupement occupe le sommet d’un tétraèdre.
Exemples: CH4, CH3Cl
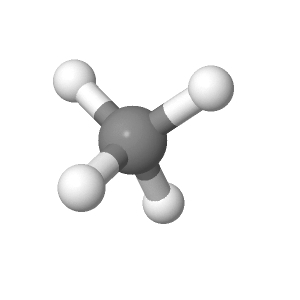
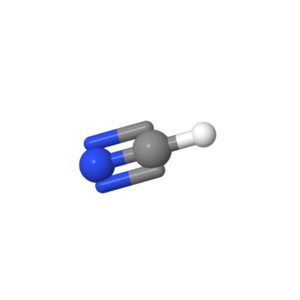
- Trois liaisons simples et un doublet non liant: Géométrie pyramidale à base triangle
Chaque groupement occupe le sommet d’un triangle formant avec l’atome centrale une pyramide au sommet, l’angle entre deux liaison est aussi de 109,5°
Exemples: NH3, PCl3
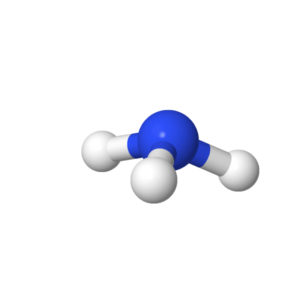
- Deux liaisons simples et deux doublets non liants: Géométrie coudée
Les deux groupements forment avec l’atome central un triangle, on dit aussi qu’il s’agit d’une forme en “V”
Exemples: H2O, H2S
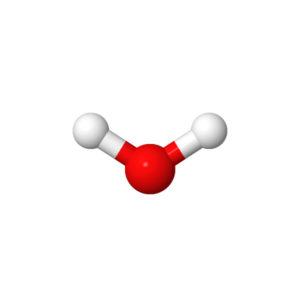
- Une liaison simple et trois doublets non liants: Géométrie linéaire
Les deux atomes sont simplement liés entre eux…
Exemples: HCl, Br2

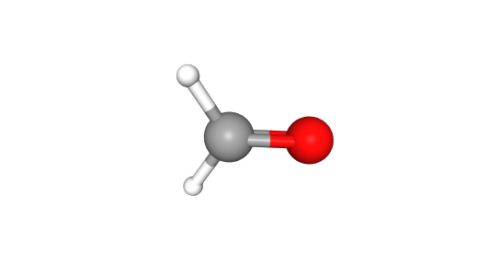
- Une double liaison, deux liaison simples et aucun doublet non liant: géométrie plane trigonale
Les trois groupements liés à l’atome central sont au sommet d’un triangle.
Exemple: H2CO, le méthanal
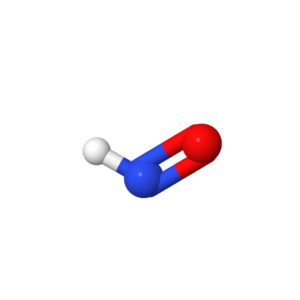
- Une double liaison, une liaison simple et un doublet non liant: coudée.
L’atome central et les deux groupements forment un triangle.
Exemple: HNO, le nitroxyle
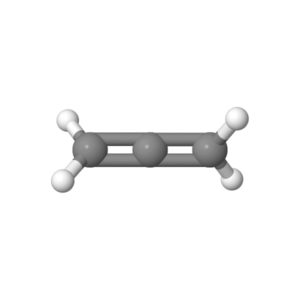
- Deux doubles liaisons, aucun doublet non liant: géométrie linéaire.
L’atome centrale et les deux groupements qu’il porte sont alignés
Exemple: le propadiene (C3H4)
- Une triple liaison et une liaison simple: géométrie linéaire
L’atome central et les deux groupements qu’il porte sont alignés
Exemple: le cyanure d’hydrogène (HCN)
Voir cours “La géométrie des molécules”
Tableau: résumé des différentes géométries moléculaires
| Répartition des doublets | Nom de la géométrie | Exemple |
| Quatre liaisons simples et aucun doublet non liant | Tétraédrique |  |
| Trois liaisons simples et un doublet non liant | Pyramidale base triangle | 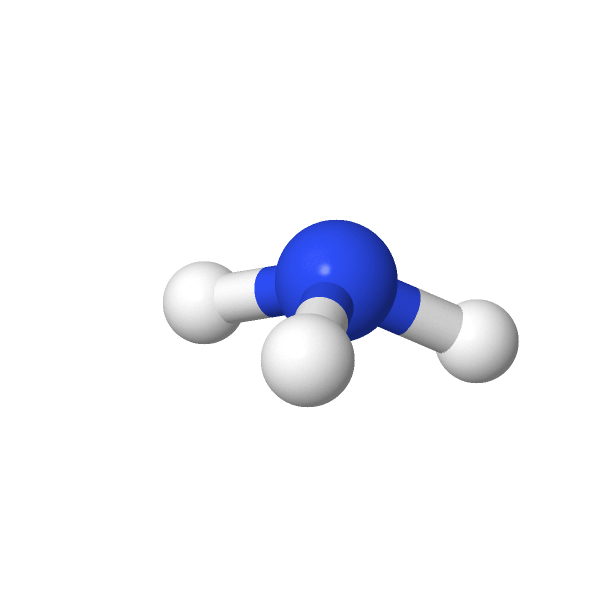 |
| Deux liaisons simples et deux doublets non liants ou Une double liaison, une liaison simple et un doublet non liant | Coudée ou en “V” | 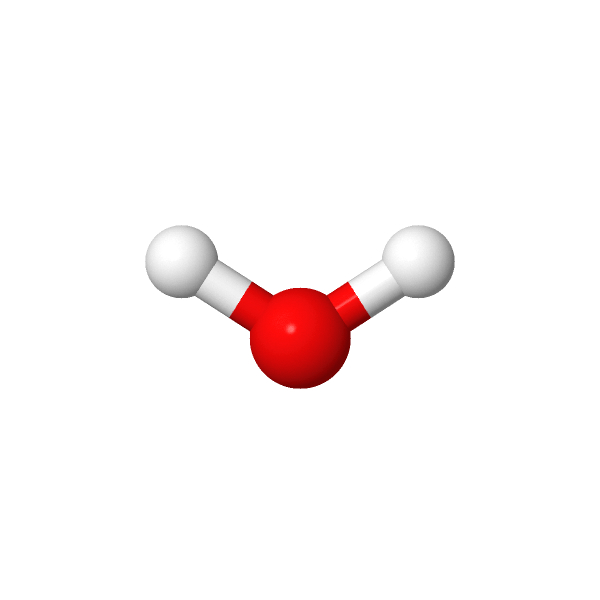 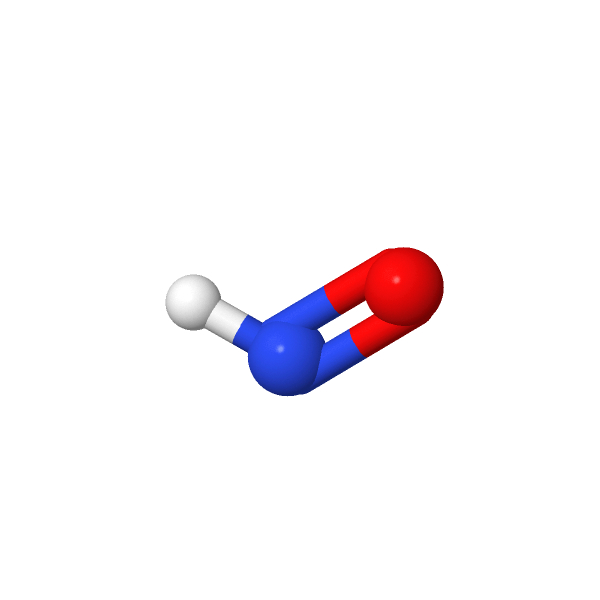 |
| Une liaison simple et trois doublets non liants ou Deux doubles liaisons, aucun doublet non liant ou Une triple liaison et une liaison simple | Géométrie linéaire |  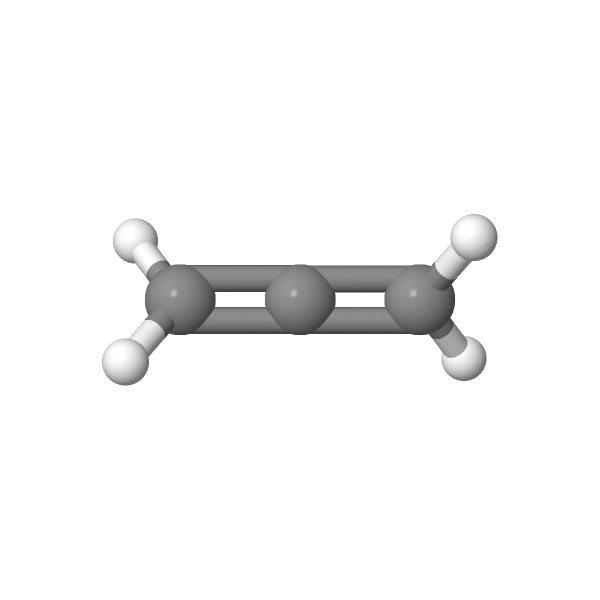 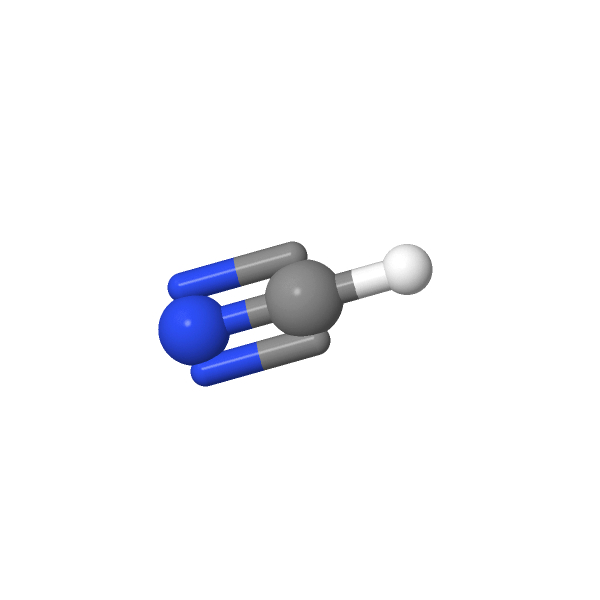 |
| Une double liaison, deux liaisons simples et aucun doublet non liant | Plane trigonale | 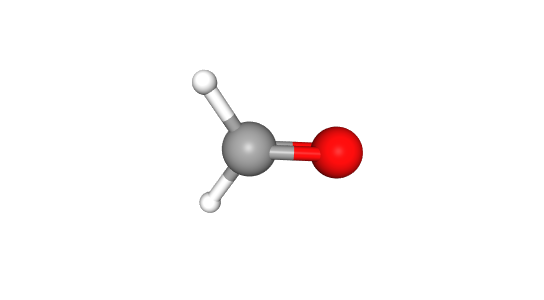 |
Voir cours “La géométrie des molécules”
Electronégativité, liaisons polarisées et molécules polaires
Electronégativité
L’électronégativité est une grandeur qui a été définie pour traduire la tendance d’un atome à attirer vers lui les électrons partagés au sein d’un doublet liant.
Par définition un doublet liant est constitué des deux électrons mis en communs par deux atomes liés, chaque atome “partage” avec l’autre un électron de sa couche de valence.
Cependant le partage de ces électrons n’est pas toujours “symétrique”, il est possible que les électrons partagés se rapprochent davantage d’un des atomes que de l’autre:
Les électrons d’une liaison (doublet liant) se décalent toujours vers l’atome le plus électronégatif.
Si des atomes ont des électronégativités égales ou très proches alors la répartition des électrons du doublet liant reste symétrique.
L’électronégativité est une grandeur:
- sans unité
- de symbole χ (lettre grecque khi minuscule)
- dont la valeur est donnée par une échelle (le plus souvent l’échelle de Pauling)
Voir cours “L’électronégativité“
Valeurs de l’électronégativité pour les éléments les plus courants
(Source: National library of Medicine)
- Hydrogène χ(H) = 2,2
- Carbone χ(C) = 2,55
- Azote χ(N) = 3,01
- Oxygène χ(O) = 3,44
- Fluor χ(F) = 3,98
- Sodium χ(Na) = 0,93
- Aluminium χ(Al) = 1,61
- Silicium χ(Si) = 1,9
- Phosphore χ(P) = 2,19
- Soufre χ(S) = 2,58
- Chlore χ(Cl) = 3,16
Voir cours “L’électronégativité”
Variation de l’électronégativité dans le tableau périodique
D’une manière générale:
L’électronégativité augmente le long d’une période du tableau périodique.
Remarque
Il s’agit d’une tendance générale mais il peut y a voir des exceptions à cette règle.
Pourquoi cette croissance de l’électronégativité le long d’une période ?
Si l’on compare les éléments d’une même ligne du tableau périodique on remarque que:
- tous les atomes d’une même période disposent de la même couche de valence, par conséquent les électrons de valence de ces atomes sont à des distances presque identiques de leur noyau.
- Le long d’une période le numéro atomique est croissant par conséquent les protons sont de plus en plus nombreux dans le noyau.
Il en résulte que le long d’une période les noyaux atomiques exercent une attraction électrique croissante sur les électrons de valence et donc sur les électrons des doublets liants: Les noyaux attirent d’avantage les électrons des doublets liants vers eux par conséquent ils sont davantage électronégatifs.
L’électronégativité diminue le long d’une colonne du tableau périodique.
Remarque
Là aussi il ne s’agit que d’une tendance générale qui souffre quelques exceptions
Pourquoi cette décroissance de l’électronégativité le long d’une colone?
Ce résultat peut s’expliquer par le fait qu’à chaque nouvelle période du tableau périodique correspond une nouvelle couche de valence, plus éloignée du noyau que les précédentes. Cette éloignement progressif de la couche de valence est le facteur qui provoque une diminution de la force électrique exercée par le noyau malgré l’augmentation du nombre de protons.
Voir cours “L’électronégativité”
Liaisons polarisées et non polarisées
Définition d’une liaison polarisée
Une liaison covalente entre deux atomes est polarisée si la différence d’électronégativité entre ces deux atomes est suffisamment élevée. (au delà de 0,4 en général)
Autre formulation équivalente de cette définition:
Si |χ(B) – χ(A)| > 0,4 alors la liaison A-B est polarisée
Remarque
Si la différence d’électronégativité est trop grande entre deux atomes (on considère que la limite est de 1,7) alors ces atomes ne peuvent plus former une liaison covalente. Il n’y a plus de “partage d’électrons”, l’atome le plus électronégatif s’accapare le ou les doublets d’électrons et forme un anion tandis que le moins électronégatif forme un cation.
Définition d’une liaison non polarisée.
Une liaison est non polarisée lorsque les deux atomes liés on une faible différence d’électronégativité (au maximum 0,4).
Autre formulation équivalente de cette définition:
Si |χ(B) – χ(A)| ≤ 0,4 alors la liaison A-B est non polarisée.
Voir cours “Les liaisons polarisées“
Charges partielles
Lorsqu’une liaison est polarisée, la différence d’électronégativité entre les deux atomes se traduit par un “décalage” des électrons du doublet liant vers l’atome le plus électronégatif:
l’ “orbite” des électrons du doublet liant est plus proches de l’atome le plus électronégatif.
En moyenne il y a donc:
- un excès d’électrons vers l’atome le plus électronégatif et donc aussi un excès de charges négatives.
- un déficit (un défaut) d’électrons vers l’atome le moins électronégatif et donc un déficit de charges négatives équivalent à un excès de charges positives.
Les deux atomes de la liaison polarisée restent donc toujours globalement neutres mais:
- on dit que l’excès de charge négative vers l’atome le plus électronégatif correspond à une charge partielle négative notée δ–
- on dit que l’excès de charge positive vers l’atome le moins électronégatif correspond à une charge partielle positive notée δ+
L’atome le moins électronégatif constitue donc un “pôle” positif tandis que l’atome le plus électronégatif correspond à un pôle négatif:
C’est en raison de l’existence de ces deux pôles que la liaison est dite “polarisée”.
Voir cours “Les liaisons polarisées”
Exemple de liaison polarisée: la liaison carbone – oxygène
L’électronégativité du carbone est de χ(C)=2,55 et celle de l’oxygène est χ(0)= 3,44.
La différence d’électronégativité est donc |χ(0)- χ(C)|= 3,44 – 2,55 = 0,89
Cette différence est bien supérieure à la limite de 0,4 ce qui confirme que la liaison est polarisée.
L’atome d’oxygène est le plus électronégatif et porte donc une charge partielle négative δ–
Le carbone est moins électronégatif et donc il porte une charge partielle positive δ+
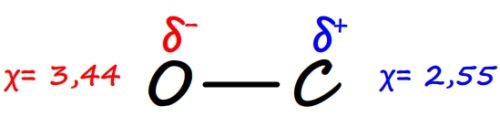
Voir cours “Les liaisons polarisées”
Quelques exemples de liaisons non polarisées
- Une liaison entre deux éléments identiques n’est jamais polarisée: la liaison carbone-carbone C-C n’est pas polarisée, la liaison hydrogène-hydrogène H-H n’est pas polarisée, la liaison Azote-Azote N-N n’est pas polarisée, Etc…
- La liaison carbone-hydrogène
L’électronégativité du carbone est de χ(C)=2,55 et celle de l’hydrogène est χ(H)= 2,2
La différence d’électronégativité est donc |χ(C)- χ(H)|= 2,55 – 2,2 = 0,35
Cette différence est inférieure à la limite de 0,4 par conséquent la liaison entre un atome de carbone et un atome d’hydrogène n’est pas polarisée.
Voir cours “Les liaisons polarisées”
Qu’est-ce qu’une molécule polaire ?
Définition
Une molécule est qualifiée de polaire si elle dispose:
- d’un pôle positif correspondant au centre des charges partielles positives.
- d’un pôle négatif correspondant au centre des charges partielles négatives.
Et à condition que ces deux pôles soient localisés en des points différents.
Par conséquent une molécule ne peut être polaire qu’à condition:
- de possèder des liaisons polarisées (au moins une).
- Que ces polarisations ne se compensent pas et que le centre des charges partielles positives ne se soit pas situé au même point que le centre des charges partielles négatives
Voir cours “Molécules polaires et apolaires“
Quelques exemples de molécules polaires
Voici quelques exemples courants de molécules polaires
- La molécule de chlorure d’hydrogène HCl
C’est une molécule composée seulement deux atomes entre lesquels il y a une liaison polarisée ( χ(H)=2,2 et χ(Cl)= 3,16 soit une différence d’électronégativité de 0,96). Par conséquent la molécule de chlorure d’hydrogène possède un centre positif situé sur l’hydrogène et un centre négatif situé sur le chlore)
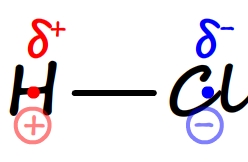
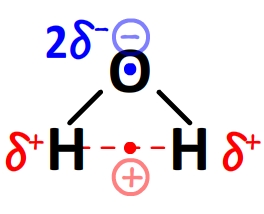
- L’eau H2O
Le centre des charges partielles négatives est localisé sur l’atome d’oxygène. (qui porte deux charges partielles négatives)
Le centre des charges partielles positives est quant à lui situé au milieu des deux atomes d’hydrogène.
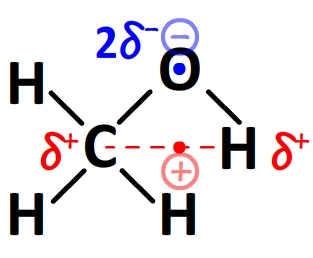
- La molécule de méthanol CH3-OH
Cette molécule possède une liaison polarisée carbone-oxygène ainsi qu’une liaison polarisée oxygène-hydrogène.
L’oxygène cumule deux charges partielles négatives et constitue le centre négatif.
Le centre positif est situé au centre du segment reliant le carbone et l’hydrogène lié à l’oxygène.
Voir cours “Molécules polaires et apolaires”
Qu’est-ce qu’une molécule apolaire ?
Définition
Une molécule apolaire est une molécule qui n’est pas polaire, c’est à dire qui ne possède pas un centre positif et un centre négatif distincts.
Il existe deux cas possibles:
- Une molécule peut être apolaire car elle ne comporte pas de liaisons polarisées, ses atomes ne présentent pas de différences d’électronégativité suffisantes. C’est le cas par exemple pour les hydrocarbures (alcanes, alcènes, alcynes) qui ne sont constitués que d’atomes de carbone et d’hydrogène formant des liaisons non polarisées.
- Une molécule peut aussi être apolaire si les différentes polarisations se compensent et que les centres des charges positives et négatives se superposent (sont localisés en un même point). C’est le cas par exemple dans le dioxyde de carbone qui comporte deux liaisons polarisées carbone-oxygène mais dont le centre positif et le centre négatif se superposent au niveau de l’atome de carbone.
Voir cours “Molécules polaires et apolaires”
Méthode pour déterminer si une molécule est polaire
- Etape 1: rechercher le schéma de Lewis de la molécule (voir partie de ce cours sur le Schéma de Lewis)
- Etape 2: rechercher la géométrie de la molécule à partir du schéma de Lewis (voir la partie du cours consacrée à la géométrie des molécules.
- Etape 3: comparer l’électronégativité des atomes de la molécule, rechercher les liaisons polarisées
S’il n’y a pas de liaisons polarisées alors on peut conclure que la molécule est apolaire.
S’il y a une seule liaison polarisée alors on peut conclure que la molécule est polaire.
- Etape 4: Placer les charges partielles positives (δ+) et les charges partielles négatives (δ–) sur les atomes des liaisons polarisées.
- Etape 5: Chercher le centre géométriques des charges partielles positive et le centre géométrique des charges partielles négative.
Si ces deux centres sont situés en des points différent alors la molécule est polaire.
Si ces deux centres sont situés au même point alors la molécule est apolaire.
Voir cours “Molécules polaires et apolaires”
A réviser
Les autres cours de première spécialité
- Quantité de matière, masse molaire et concentration
- Réaction d’oxydoréduction et avancement
- Titrage colorimétrique redox
- Schéma de Lewis, géométrie, électronégativité et polarisation
- Cohésion des solides, dissolution, solubilité, hydrophilie et lipophilie
- Structure et nomenclature des espèces organiques
- Synthèse organique
