Cours de chimie niveau seconde – Constitution et transformations de la matière – Partie 1: de l’échelle macroscopique à l’échelle microscopique – B) Modélisation de la matière à l’échelle microscopique – Le cortège électronique de l’atome définit ses propriétés chimiques.
- Couche de valence: définition
- Electrons de valence: définition
- Comment trouver la couche de valence ?
- Comment trouver le nombre d’électrons de valence
- Couche de valence des atomes d’une même période
- Electrons de valence des atomes d’une même famille
- Electrons de valence et propriétés chimiques
- Electrons de valence d’un ion monoatomique
- Electrons de valence d’un atome dans une molécule
- Electrons de valence et représentation de Lewis
Couche de valence: définition
Par définition la couche de valence d’un atome (ou d’un ion) correspond à la plus haute couche électronique occupée par des électrons.
Cette couche comporte les électrons les plus éloignés du noyau, elle constitue la limite entre l’atome et l’espace extérieur. C’est cette couche et ses électrons qui sont amenés à interagir avec les autres entités chimiques et c’est d’elle dont dépendent les propriété chimique d’un atome.
Remarque: la couche de valence d’un atome est aussi appelée couche externe.
Electrons de valence: définition
Définition: Les électrons de valence d’un atome sont les électrons appartenant à la couche de valence d’un atome.
Ce sont les électrons dont l’orbite est la plus éloignée du noyau et qui sont les plus exposés aux autres entités chimiques. Les électrons de valence d’un atome sont responsables des propriétés chimiques de cet atome, ce sont eux qui peuvent être perdus lors de la transformation en cation et ce sont aussi eux qui permettent à l’atome de se lier (pour former des liaisons dites covalentes).
Remarque
Les électrons de valence sont aussi appelés électrons externes.
Comment trouver la couche de valence ?
La couche de valence d’un atome peut être déterminée à partir de sa configuration électronique: il s’agit de la dernière couche notée dans cette configuration électronique.
Exemples
- L’hélium a pour configuration électronique 1s2 par conséquent sa couche de valence correspond à la seule et unique couche occupée: la couche n°1
- Le béryllium a pour configuration électronique 1s22s2 , sa couche de valence est la couche n°2
- La configuration électronique de l’oxygène est 1s22s22p4 donc la couche n°2 correspond à sa couche de valence
- La couche de valence de l’aluminium est sa couche n°3 car sa configuration électronique est 1s22s22p63s23p1
Il est aussi possible de trouver la couche de valence d’un atome en utilisant le tableau périodique, plus précisément en repérant la période (la ligne) où l’élément est situé:
Le numéro de la couche de valence correspond au numéro de la période
Comment trouver le nombre d’électrons de valence
Il est possible de déterminer le nombre d’électrons de valence d’un atome isolé à partir de configuration électronique: il suffit de repérer la dernière couche (la couche de valence) et de déterminer le nombre d’électrons total sur cette couche (en ajoutant les électrons présents sur les différentes sous-couches de la couche de valence)
Exemples
- L’atome de lithium (Z=3) a pour configuration électronique 1s22s1 , sa couche de valence est la couche n°2, elle ne comporte qu’une seule sous-couche (2s) qui ne comporte qu’un électron par conséquent le lithium possède un seul électron de valence.
- L’atome d’oxygène (Z=8) a pour configuration électronique 1s22s22p4 sa couche de valence est couche n°2, elle comporte une sous-couche 2s avec deux électrons ainsi qu’une sous-couche 2p qui possède 4 électrons par conséquent l’atome d’oxygène possède un total de 2+4 = 6 électrons de valence.
- L’atome d’aluminium (Z=13) a pour configuration électronique 1s22s22p63s23p1 sa couche de valence est couche n°3, elle comporte une sous-couche 3s avec deux électrons ainsi qu’une sous-couche 3p qui possède 1 électron par conséquent l’atome d’aluminium possède un total de 2+1 = 3 électrons de valence.
Il est aussi possible de déterminer le nombre d’électrons de valence d’un atome à partir de la colonne du tableau périodique où il est situé (voir pargraphe “Electrons de valence des atomes d’une même famille”)
Couche de valence des atomes d’une même période
Le tableau périodique classe les éléments chimiques en tenant compte de leur configuration électronique, l’une de ses règles est de faire figurer sur une même période (ligne) uniquement des éléments ayant la même couche de valence.
Par conséquent:
- Les atomes correspondant à des éléments de la première période (hydrogène, hélium) ont tous comme couche valence la couche n°1
- La forme atomique des éléments de la deuxième période ( lithium, de béryllium, de bore, de carbone, d’azote, d’oxgène, de fluor et de néon) possèdent comme couche valence la couche n°2
- Les éléments de la couche n°3 (sodium, de magnésium, d’aluminiun, de silicium, de phosphore, de soufre, de chlore et d’argon) correspondent tous à des atomes dont la couche valence est la couche n°3
Electrons de valence des atomes d’une même famille
Les éléments du tableau périodique sont classés de manière à ce que tous les éléments d’une même colonne disposent du même nombre d’électrons sur leur couche de valence
ainsi:
- Tous les atomes de la première colonne (hydrogène, lithium et sodium…) ont un électrons de valence
- Tous les atomes de la deuxième colonne (Béryllium, magnésium…) ont deux électrons de valence
Si on se limite au au trois premières périodes du tableau périodique alors voici les électrons de valence des éléments des huit colonnes:
| Colonne | Elements de la colonne | Nombre d’électrons de valence des atomes |
| Première (numéro 1) | Hydrogène, lithium et sodium | 1 |
| Deuxième (numéro 2) | Béryllium, magnésium | 2 |
| Troisième (numéro 13 dans le tableau) | Bore, aluminium | 3 |
| Quatrième (numéro 14 dans le tableau) | Carbone, silicium | 4 |
| Cinquième (numéro 15 dans le tableau) | Azote, Phosphore | 5 |
| Sixième (numéro 16 dans le tableau) | Oxygène, Soufre | 6 |
| Septième (numéro 17 dans le tableau) | Fluor, chlore | 7 |
| Huitième (numéro 18 dans le tableau) | Néon, argon |
8
(Sauf pour l’hélium qui en a 2) |
Electrons de valence et propriétés chimiques
Les électrons de valence d’un atome constituent sa frontière, ils sont exposés au milieu extérieur avec lequel ils sont susceptibles d’interagir.
Au cours d’une transformation chimique ce sont les électrons de valence qui interviennent lors de la formation ou la rupture des liaisons de covalence ainsi que dans le processus de formation des ions
Par conséquent:
Les propriétés chimiques d’un atome dépendent de ses électrons de valence.
Les autres électrons sont parfois qualifiés d’électrons de coeur, ils sont séparé du milieu extérieur par la couche externe qui constitue en quelque sorte une “barrière” limitant fortement leurs interactions avec ce milieu extérieur. Les électrons de coeurs n’interviennent donc pas dans les processus chimiques.
Puisque les éléments d’une même famille ont le même nombre d’électrons de valence ils ont donc aussi des propriétés chimiques proches.
Par exemple tous les halogènes (éléments de l’avant-dernière colonne du tableau périodique):
- Forment des ions halogénure de formule type X– c’est à dire portant chacun un électron excédentaire (F–, Cl–, Br–….)
- Sous leur forme atomique forment tous une liaison covalente
Electrons de valence d’un ion monoatomique
Si l’on connait le numéro atomique d’un atome et la formule de l’ion monoatomique qu’il forme alors on peut déterminer le nombre d’électrons de valence de cet ion. En effet la charge excédentaire précisée dans la formule d’un ion permet de déterminer le nombre d’électrons gagnés ou perdus par rapport à la forme atomique. Il suffit d’utiliser cette donnée pour trouver le nombre total d’électrons de l’ion afin d’obtenir sa configuration électronique et d’en déduire son nombre d’électrons sur sa couche de valence.
Par conséquent pour trouver les électrons de valence d’un ion:
- on détermine le nombre d’électron de l’ion (en général à partir du numéro atomique de l’élément chimique et de la formule de l’ion ou en exploitant les règles de stabilité)
- on trouve configuration électronique.
- on identifie sa couche de valence (qui n’est pas nécessairement la même que celle de la forme atomique en particulier pour les cations)
- on en déduite le nombre d’électrons de valence en comptant le nombre d’électrons sur la couche de valence.
Exemples
Le soufre (Z=16) forme l’ion monoatomique sulfure de formule chimique S2-.
L’atome de soufre possède 16 électrons (Z=16) et l’ion sulfure possède deux électrons supplémentaire (puisque qu’il porte deux charges négatives excédentaires indiquées par l’exposant 2-).
Par conséquent l’ion sulfure possède un total de 16 + 2 = 18 électrons.
La configuration électronique de l’ion sulfure est donc: 1s22s22p63s23p6
Sa couche de valence est la couche n°3
L’ion sulfure possède donc un total de 2 + 6 = 8 électrons de valence.
Le sodium (Z=11) forme l’ion monoatomique sodium de formule chimique Na+.
L’atome de sodium possède 11 électrons (Z=11) et l’ion sodium possède un électron de moins (puisque qu’il porte une charges positive excédentaires indiquée par l’exposant +).
Par conséquent l’ion sodium possède un total de 11 – 1 = 10 électrons.
La configuration électronique de l’ion sulfure est donc: 1s22s22p6
Sa couche de valence est la couche n°2
L’ion sulfure possède donc un total de 2 + 6 = 8 électrons de valence.
Les règles de stabilité (règles du duet et de l’octet) impliquent que les ions des trois premières périodes du tableau périodique possèdent soit deux soit huit électrons de valence (ou exceptionnellement aucun).
Ces règle de déduire:
- qu’il y a 2 électrons de valence pour les ions lithium hydrure (H–), (Li+), béryllium (Be2+) et bore (B3+)
- qu’il y a huit électrons de valence pour les ions oxyde (O2-), fluorure (F–), sodium (Na+), magnésium (Mg2+), aluminium (Al3+), sulfure (S2-), chlorure (Cl–), Potassium (K+) et Calcium (Ca2+).
- L’ion hydrogène (H+) est une exception qui ne possède aucun électron de valence.
Electrons de valence d’un atome dans une molécule
Lorsqu’un atome fait partie d’une molécule il forme une ou plusieurs liaisons covalentes avec d’autres atomes.
Chaque liaison covalente formée par un atome lui permet de bénéficier d’un électron supplémentaire dans sa couche valence (voir règles de stabilités):
- Un atome qui forme une liaison covalente possède un électron de valence de plus que l’atome isolé.
- Un atome qui forme deux liaisons covalentes possède deux électrons de valence supplémentaires par rapport à sa forme atomique isolée.
- Un atome avec trois liaisons bénéficie de trois électrons de valence en plus par rapport à l’atome seul.
- Etc…
Les règles de stabilité (règles du duet et de l’octet) conduisent à former des molécules où les atomes des trois premières périodes possèdent soit deux électrons de valence soit huit électrons de valence:
- Dans une molécule l’atome d’hydrogène (H) a deux électrons de valence
- Dans une molécule les atomes de carbone (C), d’azote (N), d’oxygène (O), de fluor (F), de silicium (Si), de phosphore (P), de soufre (S) et de chlore (Cl) possèdent chacun huit électrons de valence.
Electrons de valence et représentation de Lewis
La représentation de Lewis est une représentation montrant tous les électrons de valence des atomes d’une molécule soit sous forme de doublets liants (liaison entre deux atomes) soit sous forme de doublets non liants.
Exemple
La représentation de Lewis de la molécule de sulfure d’hydrogène est la suivante:
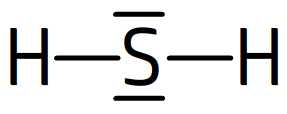
on peut déduire de cette représentation:
- que l’hydrogène, entouré d’un seul doublet liant, y possède deux électrons de valence.
- que le soufre entouré de quatre doublets (deux liants et deux non liants) y possède 4 x 2 = 8 électrons de valence.
