- Définition
- Masse molaire des nucléons
- Masse molaire atomique
- Liste de masses molaires atomiques
- Masse molaire moléculaire
- Liste de quelques masses molaires moléculaires
- Masse molaire ionique
- Masse molaire d’un composé ionique
- Déterminer une masse molaire
- Calculer une masse
- Calculer une quantité de matière
Définition de la masse molaire
Définition: la masse molaire d’une espèce chimique (atomique, moléculaire ou ionique) correspond à la masse que possède une mole de cette espèce chimique.
C’est une grandeur qui se note M (toujours en majuscule pour la distinguer de la masse) et qui peut être accompagnée du nom ou de la formule brute de l’espèce chimique concernée placée entre parenthèses ou en indice.
D’après cette définition, si l’on connait la masse mparticule d’une particule microscopique alors la masse molaire M de l’espèce chimique est donnée par la formule suivante:
M= mparticule . NA
Elle peut être exprimée comme le rapport de la masse “m” d’un échantillon de l’espèce chimique par la quantité de matière “n” contenue dans cet échantillon. Cette relation peut être traduite par la formule suivante:
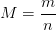
- M : masse molaire de l’espèce chimique en gramme par mol (g/mol ou g.mol-1)
- m : masse de l’échantillon de l’échantillon en gramme (g)
- n : quantité de matière de l’échantillon en mole (mol)
Masse molaire des nucléons
Rappel: les nucléons sont les particules qui constituent le noyau atomique, il en existes deux sortes qui sont les protons et les neutrons.
Les protons et les neutrons ont des masses très proches:
Si l’on se limite à une précision de 3 chiffres significatifs alors on peut considérer qu’un nucléon (un neutron ou un proton) a une masse de 1,67.10-27 kg.
Dans ce cas la masse molaire des nucléons est:
Mnucleon = mnucleon.NA
= 1,67.10-27 . 6,02.1023 kg
= 1,00.10-3 kg/mol
= 1,00 g/mol
La masse molaire des nucléons est de 1 g/mol
Masse molaire atomique
Par définition, la masse molaire d’une espèce chimique atomique correspond à la masse d’une mole d’atomes or chaque atome est composé d’électrons et d’un noyau constitué de nucléons. Si le numéro atomique d’un atome est Z et son nombre de nucléons A alors il est composé de:
La masse de l’atome peut être considérée comme la somme des masses de ces particules mais on peut faire les approximations suivantes:
- la masse des électrons (9,109.10-31kg) est négligeable devant celle des nucléons (1,67.10-27 kg) en particulier si l’on se limite à une précision de 3 chiffres significatifs, à 0,01. 10-27 kg près.
- la masse d’un proton et d’un nucléon sont les mêmes, la masse d’un nucléon vaut environ 1,67.10-27 kg
On peut donc faire l’approximation que la masse d’un atome est celle des nucléons de son noyau et comme un nucléon a une masse molaire de 1,00 g/mol alors une espèce chimique atomique dont le nombre de nucléons est A possède donc une masse molaire de A.1,00 g/mol.
Le nombre de nucléons A (aussi appelé nombre de masse) d’une espèce chimique atomique correspond aussi à sa masse molaire exprimée en g/mol
Exemples
La masse molaire du carbone 12 est de 12 g/mol
Celle de l’oxygène 16 est de 16 g/mol
Celle du phosphore 31 est de 31 g/mol
etc
Pour connaître la masse molaire d’une espèce chimique atomique il suffit donc de consulter le tableau périodique et de repérer son nombre de nucléons.
Remarque
Le tableau périodique fournit souvent des expressions décimales du nombre de nucléons car elle se réfère au nombre moyen de nucléons d’un élément chimique dans un échantillon naturel qui est général constitué d’un mélange d’isotopes.
Liste de masses molaire atomiques
| Elément | Masse molaire (g/mol) |
Elément | Masse molaire (g/mol) |
| Actinium | 227,0 | Néon | 20,2 |
| Aluminium | 27,0 | Neptunium | 237,0 |
| Américium | 243,0 | Nickel | 58,9 |
| Antimoine | 121,8 | Niobium | 92,9 |
| Argent | 107,9 | Nobélium | 259,0 |
| Argon | 39,9 | Osmium | 190,2 |
| Arsenic | 74,9 | Or | 197,0 |
| Astate | 210,0 | Oxygène | 16,0 |
| Azote | 14,0 | Palladium | 106,4 |
| Baryum | 137,3 | Phosphore | 31,0 |
| Berkélium | 247,0 | Platine | 195,1 |
| Berrylium | 9,0 | Plomb | 207,2 |
| Bismuth | 209,0 | Plutonium | 244 |
| Bohrium | 264 | Polonium | 209,0 |
| Bore | 10,8 | Potassium | 39,1 |
| Brome | 79,9 | Praséodyme | 140,9 |
| Cadmium | 112,4 | Prométhium | 145,0 |
| Calcium | 40,1 | Protactinium | 231,0 |
| Californium | 251,0 | Radium | 226,0 |
| Carbone | 12,0 | Radon | 222,0 |
| Cérium | 140,1 | Rhénium | 186,2 |
| Césium | 132,9 | Rhodium | 102,9 |
| Chlore | 35,5 | Rubidium | 85,5 |
| Chrome | 52,0 | Ruthénium | 101,1 |
| Cobalt | 58,9 | Rutherfordium | 261 |
| Cuivre | 63,5 | Samarium | 150,4 |
| Curium | 247,0 | Scandium | 45,0 |
| Darmstadtium | 281 | Seaborgium | 266 |
| Dubnium | 262 | Sélénium | 79,0 |
| Dysprosium | 162,5 | Silicium | 28,1 |
| Einsteinium | 254,0 | Sodium | 23,0 |
| Erbium | 167,3 | Strontium | 87,6 |
| Etain | 118,7 | Soufre | 32,1 |
| Europium | 152,0 | Tantale | 180,9 |
| Fer | 55,8 | Technétium | 98,9 |
| Fermium | 257,0 | Tellure | 127,6 |
| Fluor | 19,0 | Terbium | 158,9 |
| Francium | 223,0 | Thallium | 204,4 |
| Gadolinium | 157,3 | Thorium | 232,0 |
| Gallium | 69,7 | Thulium | 168,9 |
| Germanium | 72,6 | Titane | 47,9 |
| Hafnium | 178,5 | Tungstène | 183,9 |
| Hassium | 277 | Ununbium | 285 |
| Hélium | 4,0 | Ununhexium | 292 |
| Holmium | 164,9 | Ununoctium | 294 |
| Hydrogène | 1,0 | Ununpentium | 288 |
| Indium | 114,8 | Ununquadium | 289 |
| Iode | 126,9 | Ununseptium | 292 |
| Iridium | 192,2 | Ununtrium | 284 |
| Krypton | 83,8 | Ununium | 280 |
| Lanthane | 138,9 | Uranium | 238,0 |
| Lawrencium | 260,0 | Vanadium | 50,9 |
| Lithium | 6,9 | Xénon | 131,3 |
| Lutétium | 175,0 | Ytterbium | 173,0 |
| Magnésium | 24,3 | Yttrium | 88,9 |
| Manganèse | 54,9 | Zinc | 65,4 |
| Meitnérium | 268 | Zirconium | 91,2 |
| Mendélevium | 258,0 | ||
| Mercure | 200,6 | ||
| Molybdène | 95,9 | ||
| Néodyme | 144,2 |
Masse molaire moléculaire
Par définition une elle correspond à la masse d’une mole de molécules appartenant à la même espèce chimique. Etant donnée qu’une molécule est constituée d’atomes liés entre eux, elle peut être obtenue par addition des masses molaires atomiques de chacun de ses constituants.
Par exemple une molécule d’eau, de formule H2O est constituée d’un atome d’oxygène lié à deux atomes d’hydrogène par conséquent une mole de molécules d’eau contient une mole d’atomes d’oxygène et deux moles d’atomes d’hydrogène. La masse molaire de l’eau est donc égale à la somme de la masse molaire de l’oxygène et du double de celle de l’hydrogène ce qui peut se traduire par la relation suivante:
M(eau) = M(H2O) = 2.M(H) + M(O)
M(eau) = 2.1,0 + 16,0
M(eau) = 18,0 g/mol
Autres exemples
Le glucose a pour formule C6H12O6 :
M( C6H12O6 ) = 6.M(C) + 12.M(H) + 6.M(O)
M( C6H12O6 ) = 6.12,0 + 12.1,0 + 6.16,0
M( C6H12O6 ) = 180,0 g/mol
Le paracétamol a pour formule C8H9NO2 :
M(C8H9NO2) = 8.M(C) + 9.M(H) + M(N) + 2.M(O)
M(C8H9NO2) = 8.12,0 + 9.1,0 + 14,0 + 2.16,0
M(C8H9NO2) = 151,0 g/mol
Liste de quelques masses molaires moléculaires
| Nom de l’espèce chimique | Formule | Masse molaire moléculaire (g/mol) |
| Acide acetique | C2H4O2 | 60,0 |
| Benzène | C6H6 | 78,0 |
| Butane | C4H10 | 58,0 |
| Caféïne | C8H10N4O2 | 194,0 |
| Chlorure d’hydrogène | HCl | 36,5 |
| Diazote | N2 | 28;0 |
| Dichlore | Cl2 | 71,0 |
| Dihydrogène | H2 | 2,0 |
| Diiode | I2 | 253,8 |
| Dioxyde de carbone | CO2 | 44,0 |
| Dioxygène | O2 | 32,0 |
| Eau | H2O | 18,0 |
| Ethane | C2H6 | 30,0 |
| Ethanol | C2H6O | 46,0 |
| Ibuprofène | C13H18O2 | 206,0 |
| Méthane | CH4 | 16,0 |
| Ozone | O3 | 48,0 |
| Paracétamol | C8H9NO2 | 151,0 |
| Pentane | C5H12 | 72,0 |
| Propane | C3H8 | 44,0 |
Masse molaire ionique
Un ion monoatomique ne diffère d’un atome que par un défaut ou un excès d’un ou plusieurs électrons or la masse de ces derniers est négligée lors du calcul d’une masse molaire atomique, par conséquent on peut faire l’approximation que la masse molaire d’un ion monoatomique est la même que celle de l’atome dont il dérive.
Exemple
L’ion sodium Na+ : sa masse molaire atomique du sodium (23,0 g/mol)
L’ion cuivre Cu2+ : sa masse molaire atomique du cuivre (63,5 g/mol)
etc
On peut faire la même approximation concernant la masse molaire d’un ion polyatomique, elle est la somme des masses molaires atomiques de ses éléments.
Exemples
L’ion carbonate a pour formule chimique CO32-, sa masse molaire est:
M(CO32-) = M(C) + 3.M(O)
= 12 + 3.16
= 60 g/mol
L’ion acétate a pour formule chimique C2H3O2–, sa masse molaire est:
M(C2H3O2–) = 2.M(C) + 3.M(H) + 2.M(O)
= 2.12 + 3.1,0 + 2.16
= 59 g/mol
Masse molaire d’un composé ionique
Un composé ionique est une espèce chimique solide à température ambiante qui consiste en l’association d’un cation (un ion positif) et d’un anion (un ion négatif)
Sa masse molaire peut être obtenue au choix:
– En additionnant la masse molaire du cation et de l’anion si ces dernières sont connues
– En additionnant la masse molaire atomique de chaque élément comme on pourrait le faire pour une molécule.
Exemples
La masse molaire du sulfate de cuivre (CuSO4) peut être obtenue par addition de la masse molaire de l’ion cuivre et de l’ion sulfate:
M(CuSO4) = M(Cu2+) + M(SO42-)
On peut également la déterminer par addition de la masse molaire du cuivre, du soufre et de 4 masses molaires de l’oxygène:
M(CuSO4) = M(Cu) + M(S) + 4.M(O)
Déterminer une masse molaire
Si la nature et la formule d’une espèce chimique sont connues alors il est possible de déterminer la masse molaire de cette espèce à partir des masses molaires atomiques indiquées dans le tableau périodique (en suivant les méthodes des paragraphes précédents)
Par ailleurs si la masse (m) et la quantité de matière (n) d’un échantillon d’une espèce chimique pure sont connues alors la masse molaire peut être calculée grâce la relation qui définit la masse molaire comme le rapport:
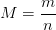
Calculer une masse
Il est également possible de modifier la relation entre masse molaire (M), masse (m) et quantité de matière (n) afin d’exprimer la masse
m = M.n
Cette relation peut par exemple être utile pour déterminer la masse des réactifs à utiliser pour être dans les conditions stöechiométriques d’une transformation chimique.
Calculer une quantité de matière
La relation qui définit la masse molaire M d’une espèce chimique comme le rapport de la masse m d’un échantillon de matière par la quantité de matière “n” peut être modifié pour exprimer la quantité de matière:
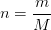
Cette relation peut par exemple être utile pour déterminer la quantité de matière obtenue lors d’une synthèse chimique (ou lors de toute transformation chimique en général)
