Cours de chimie niveau seconde – Constitution et transformations de la matière – Partie 1: de l’échelle macroscopique à l’échelle microscopique – A. Description et caractérisation de la matière à l’échelle microscopique
Voir aussi la version vidéo de ce cours de physique
1) Qu’est-ce qu’une solution ?
Une solution est un mélange homogène composé:
- d’une espèce chimique liquide constituant le composant majoritaire appelé solvant
- d’une ou de plusieurs autres espèces chimiques minoritaires appelées de solutés
2) Qu’est-ce qu’une solution aqueuse?
Une solution est dite aqueuse si le solvant est de l’eau.
Définition: une solution aqueuse est un mélange homogène constituée majoritairement d’eau et d’autres espèces chimiques dissoutes.
Les solutés sont le plus souvent des composés initialement solides mais ils peuvent aussi être liquides ou gazeux.
Voir fiche de cours “les solutions aqueuses”
3) Concentration en masse
La concentration en masse (aussi appelée concentration massique) est une grandeur reflétant la proportion d’un soluté dans une solution aqueuse.
Si une solution aqueuse contient une masse “m” de soluté dissout dans une solution aqueuse de volume “V” alors la concentration massique “Cm” correspond au rapport de la masse “m” par le volume “V”:
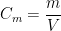
où:
- la masse “m” de soluté est en gramme (g)
- le volume de solution “V” est litre (L)
- la concentration massique “Cm” est exprimée en gramme par litre (g.L-1)
Exemple
Une solution aqueuse a un volume de 250 mL et contient 10,0 g de glucose dont la concentration massique a pour valeur:
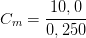
Cm =40 g.L-1
Voir fiche de cours “Concentration massique“
4) Concentration en masse maximale
La quantité de soluté qu’il est possible de dissoudre dans de l’eau est toujours limitée et dépend du soluté.
Définition
La concentration en masse maximale d’un soluté correspond à la valeur de concentration en masse la plus élevée qui peut être atteinte pour ce soluté.
La concentration en masse maximale d’un soluté est aussi appelée solubilité.
La solubilité est notée “s” et s’exprime avec la même unité que n’importe quelle concentration en masse c’est à dire en gramme par litre.
Par exemple la solubilité du carbonate de sodium dans l’eau est s=21,5 g.L-1 ce qui signifie qu’un litre de solution aqueuse peut au maximum comporter 21,5 g de carbonate de sodium dissout.
Lorsque la concentration en masse d’un soluté atteint sa valeur maximale alors la solution est dite saturée en ce soluté.
Si l’on ajoute une quantité supplémentaire de soluté dans une solution déjà saturée alors celui-ci ne dissous pas et forme avec la solution un mélange hétérogène.
Attention à ne pas confondre l’expression de la concentration massique et celle de la masse volumique, toutes les deux sont le rapport d’une masse par un volume mais dans le cas de la masse volumique la masse qui intervient est la masse totale (et non la masse d’un soluté).
Voir fiche de cours “Solubilité“
5) Préparation d’une solution
Il existe deux méthodes pour préparer une solution aqueuse:
- par dissolution
- par dilution
a) Préparation d’une solution aqueuse par dissolution
La solution est préparée en dissolvant le soluté dans l’eau
Méthode
La masse “m” de soluté à dissoudre est pesée puis introduite dans une fiole jaugée dont la contenance correspond à un volume “V”
L’eau est ajoutée avec une agitation régulière (pour dissoudre le soluté) jusqu’à atteindre le trait de jauge.
Le mélange obtenu est alors une solution aqueuse de concentration en masse Cm de valeur:
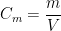
Voir “préparer une solution aqueuse“
b) Préparation d’une solution aqueuse par dilution
La solution est préparée par ajout d’eau à une autre solution aqueuse.
La solution utilisée pour la préparation est qualifiée de solution mère tandis que la solution préparée est qualifiée de solution fille.
Méthode
- Un volume V0 de solution mère de concentration Cm0 est prélevée (avec une pipette jaugée) puis ajoutée dans une fiole jaugée de volume “V”.
- De l’eau est ajoutée jusqu’au trait de jauge afin d’obtenir une solution diluée (une solution fille)
La solution fille préparée par dissolution contient une masse m = Cm0 x V0 de soluté dissous dans un volume “V” de solution par conséquent la concentration en masse de la solution est:
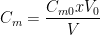
Voir fiche de cours “dilution“
5) Déterminer une concentration en masse grâce à un dosage par étalonnage
La valeur de la concentration en masse d’une solution influence certaines de ses caractéristiques et en particulier sa teinte (si le soluté est coloré) ou sa masse volumique:
- La teinte d’une solution est d’autant plus prononcée que la concentration en soluté colorée est élevée
- La masse volumique d’une solution croit avec la concentration en masse.
Un dosage par étalonnage repose sur l’utilisation de solutions de concentrations en masses connues et décroissantes (préparées en général par dilution) qui constituent une gamme de solutions étalons.
En comparant une solution de concentration inconnue aux solutions étalons il est possible de déterminer une valeur ou un encadrement de concentration recherchée.
Voir fiche “réaliser et utiliser une échelle de teinte“
Les autres cours de physique-chimie niveau seconde
- Corps purs et mélanges au quotidien
- Les solutions aqueuses, un exemple de mélange
- Du macroscopique au microscopique, de l’espèce chimique à l’entité
- Le noyau de l’atome, siège de sa masse et de son identité
- Le cortège électronique de l’atome définit ses propriétés chimiques
- Vers des entités plus stables chimiquement
- Transformation physique
- Transformation chimique
- Transformation nucléaire
- Décrire un mouvement
- Modéliser une action sur un système
- Principe d’inertie
- Emission et perception d’un son
- Vision et image
- Circuits électriques
- Capteurs
