Cours de chimie niveau seconde –2. Modélisation des transformations de la matière et transfert d’énergie– B) Transformation physiques
Voir aussi la version vidéo de ce cours de physique
Qu’est-ce qu’une transformation physique ?
Définition: une transformation physique est une transformation au cours de laquelle les espèces chimiques se conservent.
Cela signifie que l’état initial et l’état final du système sont constitués d’espèces chimiques de même nature et en même quantité.
Si par exemple un système est composé de 2,5 mol d’eau, de 0,2 mol de dioxyde carbone et de 3,2 mol de diazote et qu’après une transformation on retrouve dans ce système uniquement 2,5 mol d’eau, 0,2 mol de dioxyde carbone et 3,2 mol de diazote on peut en conclure qu’il s’agit d’une transformation physique.
Les principales sortes de transformations physiques sont:
- Les changements d’état (fusion, vaporisation, liquéfaction, solidification, sublimation et condensation)
- Les dissolutions
- La formation de mélanges homogènes ou hétérogènes
- Les compressions ou détentes
- Le réchauffement ou le refroidissement d’un matériau
Voir cour ” Distinguer les transformations physiques “
Aspects microscopiques des changements d’états
Les différents changements d’état sont:
- La fusion
- La vaporisation
- La liquéfaction
- La solidification
- La sublimation
- La condensation
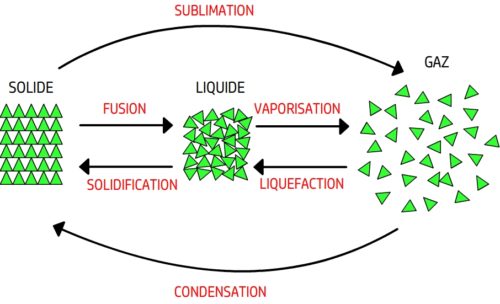
Lors d’un changement d’état l’organisation microscopique des entités chimiques est modifiée.
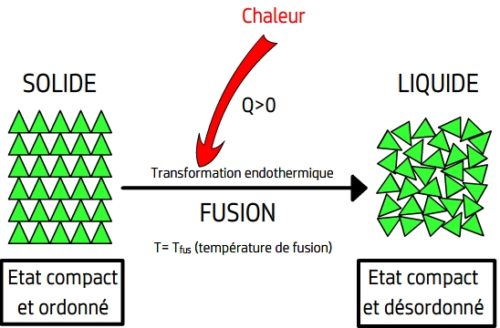
- Lors d’une fusion les entités chimiques, initialement fixes les unes par rapport aux autres, gagnent la possibilité de se déplacer tout en restant au contact les unes avec les autres.
La fusion est le passage d’un état compact et ordonné à un état compact et désordonné.
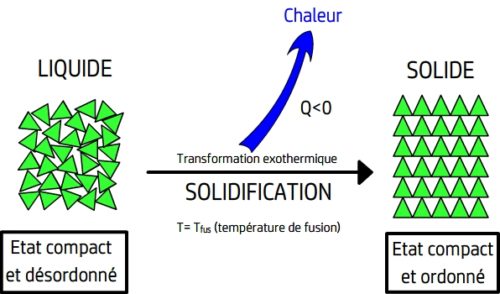
- Lors d’une solidification il se produit le phénomène inverse de la fusion: les entités chimiques se figent et perdent totalement leur mobilité.
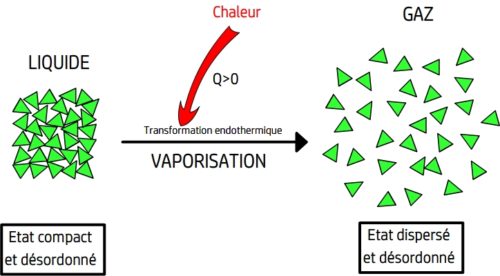
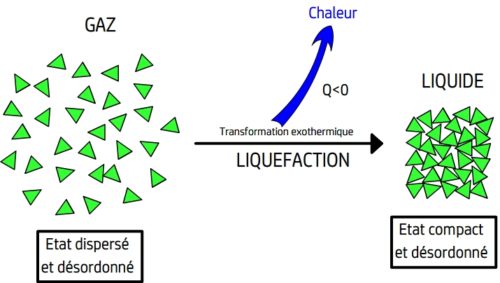
- Lors d’une vaporisation les entités chimiques s’éloignent les unes des autres et cessent d’être en contact les unes avec les autres.
La vaporisation est le passage d’un état compact et désordonné à un état dispersé et désordonné
- Lors d’une liquéfaction se produit le phénomène inverse, les entités chimiques libres de se déplacer se rapprochent les unes des autres et retrouvent la contrainte d’un contact permanent avec les autres entités chimiques.
Voir cours:
Cas particulier des dissolutions
Le cas particulier de la dissolution est évoqué ici car c’est un phénomène physique parfois confondu avec la fusion.
En effet lorsqu’un solide se dissout dans un liquide il se forme un mélange liquide homogène (à condition de ne pas dépasser la limite de solubilité) cependant il ne s’agit pas d’un changement d’état.
Lors d’une fusion:
- l’état initial ne comprend qu’un corps pur solide
- il peut n’y avoir qu’une seule espèce chimique qui intervienne.
- la fusion ne peut avoir lieu que si le solide reçoit de l’énergie thermique de la part du milieu extérieur
Lors d’une dissolution:
- l’état initial comprend un corps solide et un liquide
- il y a toujours au moins deux espèces chimiques qui interviennent.
- les entités chimiques du solide se dispersent parmi les entités chimiques du liquide
- un échange de chaleur n’est pas indispensable.
Equation de changement d’état
Un changement d’état peut être représenté de manière symbolique par une équation de changement d’état.
Cette équation est notée en précisant l’état physique de l’espèce chimique avant et après le changement d’état:
L’espèce chimique est représentée par sa formule chimique.
Un équation de changement d’état sera donc de la forme:
Formule de l’espèce chimique (état initial) → Formule de l’espèce chimique (état final)
- Pour une fusion l’équation sera du type:
Formule de l’espèce chimique (s) → Formule de l’espèce chimique (l)
Exemple:
H2O(s) → H2O(l)
- Pour une solidification l’équation sera du type:
Formule de l’espèce chimique (l) → Formule de l’espèce chimique (s)
Exemple:
H2O(l) → H2O(s)
- Pour une vaporisation l’équation sera du type:
Formule de l’espèce chimique (l) → Formule de l’espèce chimique (g)
Exemple:
H2O(l) → H2O(g)
- Pour une liquéfaction l’équation sera du type:
Formule de l’espèce chimique (g) → Formule de l’espèce chimique (l)
Exemple:
H2O(g) → H2O(l)
Voir cours ” Les changements d’état “
Evolution de la température lors d’un changement d’état
Tout changement d’état d’un corps pur se fait à une température constante
Sur un graphique montrant l’évolution de la température au cours du temps le changement d’état d’un corps pur se manifeste par palier c’est à dire par une zone horizontale.
La fusion d’un corps pur se fait à la température de fusion du corps pur.
Tant que toutes les entités chimiques ne sont pas capables de se mouvoir l’énergie thermique reçue ne provoque pas de hausse de température mais permet de “briser” les interactions attractives qui s’exercent entre les entités chimiques du solide.
Lors d’une solidification le phénomène inverse se produit. La solidification survient à une température constante appelée température de solidification qui a même valeur que la température de fusion:
Tsolidification = Tfusion
Tant qu’il reste des entités chimiques mobiles l’énergie thermique perdue ne provoque pas de baisse de température mais rétablit l’immobilité des entités chimiques.
La vaporisation d’un corps se fait à une température constante appelée température de vaporisation.
Tant que toutes les entités chimiques ne sont pas toutes séparées les unes des autres l’énergie thermique reçue ne provoque pas de hausse de température mais permet d’éloigner les entités chimiques du liquide les unes des autres.
Lors d’une liquéfaction le phénoméne inverse se produit.
La liquéfaction se produit à une température constante appelée température de liquéfaction qui a même valeur que la température de vaporisation:
Tliquéfaction = Tvaporisation
Tant qu’il reste des entités chimiques éloignées les unes des autres l’énergie thermique perdue ne provoque pas de baisse de température mais rétablit le contact entre les entités chimiques.
Energie de changement d’état
Chaque changement d’état s’accompagne d’un échange d’énergie thermique (on utilise parfois le terme de “chaleur”) entre le corps qui change d’état et le milieu extérieur.
Cette énergie de changement d’état est noté Q et s’exprime en Joule, J (comme toutes les énergies)
Par convention cette énergie thermique peur être positive ou négative selon le sens de l’échange:
- Si un corps reçoit de l’énergie thermique (l’échange se fait du milieu extérieur vers le corps) alors cette énergie est positive, Q > 0
- Si un corps cède de l’énergie thermique (l’échange se fait du corps vers le milieu extérieur) alors cette énergie est négative , Q < 0
L’énergie thermique échangée par un corps de masse “m” est proportionnelle à cette masse et à une grandeur caractéristique de ce corps appelée énergie thermique massique.
L’énergie thermique échangée pendant un changement d’état peut donc être calculée grâce à la relation suivante:
Q = m x L
où :
- Q est l’énergie thermique échangée pendant le changement d’état en joule (J)
- m est la masse de corps ayant changé d’état en kilogramme (kg)
- L est l’énergie massique de changement d’état en joule par kilogramme (J.kg-1)
Voir cours ” L’énergie massique de changement d’état “
L’énergie massique de changement d’état
Chaque corps pur est caractérisé par une énérgie massique de changement d’état qui lui est propre.
Elle se note toujours “L” en précisant souvent le changement d’état concerné (fusion, vaporisation…) et en ajoutant parfois le nom ou la formule chimique.
Elle s’exprime en joule par kilogramme (J.kg-1)
- L’énergie massique de fusion se note Lfusion (ou Lfus)
- L’énergie massique de solidification se note Lsolidification (ou Lsol)
- L’énergie massique de vaporisation se note Lvaporisation (ou Lvap)
- L’énergie massique de liquéfaction se note Lliquéfaction (ou Lliq)
Des changements d’état inverses possèdent des énergies massiques opposées:
- Lsolidification = – Lfusion
- Lliquéfaction = – Lvaporisation
Voir cours ” L’énergie massique de changement d’état “
Transformations physiques endothermiques et exothermiques
Définitions
Une transformation est dite endothermique si le système subissant la transformation reçoit de l’énergie thermique.
Une transformation est dite exothermique si le système subissant la transformation cède de l’énergie thermique.
Par conséquent:
- Pour un changement d’état endothermique: Q > 0 et L >0
- Pour un changement d’état exothermique: Q < 0 et L < 0
- La fusion et la vaporisation sont toujours endothermiques : Lfusion > 0 et Lvaporisation >0
- La solidification et la liquéfaction sont toujours exothermiques: Lsolidification < 0 et Lliquéfaction <0
Les autres cours de physique-chimie niveau seconde
- Corps purs et mélanges au quotidien
- Les solutions aqueuses, un exemple de mélange
- Du macroscopique au microscopique, de l’espèce chimique à l’entité
- Le noyau de l’atome, siège de sa masse et de son identité
- Le cortège électronique de l’atome définit ses propriétés chimiques
- Vers des entités plus stables chimiquement
- Transformation physique
- Transformation chimique
- Transformation nucléaire
- Décrire un mouvement
- Modéliser une action sur un système
- Principe d’inertie
- Emission et perception d’un son
- Vision et image
- Circuits électriques
- Capteurs