Cours de chimie niveau seconde –2. Modélisation des transformations de la matière et transfert d’énergie– B) Transformations chimiques
Voir aussi la version vidéo de ce cours de physique
- Qu’est qu’une transformation chimique ?
- La réaction chimique
- Règles de conservation
- Ecrire une équation de réaction chimique équilibrée
- Espèce chimique spectatrice
- La stoechiométrie
- Quelques équations à savoir écrire et équilibrer
- Le réactif limitant
- Transformations chimiques endothermiques et exothermiques
- Synthèse chimique
Qu’est qu’une transformation chimique ?
Définition
Une transformation chimique est une transformation au cours de laquelle des espèces chimiques sont produites tandis que d’autres sont consommées.
Au cours d’une transformation chimique les espèces chimiques ne se conservent pas ( la nature et la quantité des espèces chimiques peut changer) par contres les éléments chimiques se conservent.
Pour démontrer qu’une transformation est une transformation chimique il suffit de vérifier au moins l’une des conditions suivantes (les autres le sont automatiquement):
- au moins une espèce chimique disparaît du système chimique
- au moins une nouvelle espèce chimique se forme
- la quantité d’au moins une espèce chimique diminue
- la quantité d’au moins une espèce chimique augmente
Différence entre transformation chimique et physique
Au cours d’une transformation physique les espèces chimiques se conservent mais elles ne se conservent pas au cours d’une transformation chimique.
Différence entre une transformation chimique et nucléaire
Au cours d’une transformation chimique les éléments se conservent mais pas au cours d’une transformation nucléaire
Voir fiches de cours: “Les transformations chimiques”
La réaction chimique
On peut modéliser une transformation chimique par une réaction chimique.
Les espèces chimiques qui sont consommées (qui disparaissent totalement où dont la quantité diminue) constituent les réactifs.
Les espèces chimiques qui se forment (qui sont des espèces chimiques nouvelles où dont la quantité augmente) constituent les produits.
La réaction chimique s’écrit sous la forme:
Réactif1 + réactif2 →produit1 + produit2
Exemple
Lors de la combustion du méthane, du méthane et du dioxygène sont consommés tandis que du dioxyde de carbone et de l’eau se forment.
Par conséquent:
La réaction chimique s’écrit:
méthane + dioxygène → dioxyde de carbone + eau
Règles de conservation
Une transformation chimique suit toujours deux règles de conservation:
- La conservation des éléments chimiques.
- La conservation de la charge électrique .
La conservation des éléments implique que:
- les réactifs sont constitués des mêmes éléments que les produits.
- la quantité de chaque éléments n’est pas modifiée par la transformation chimique.
La conservation de la charge électrique implique:
Ecrire une équation de réaction chimique équilibrée
Une équation de réaction est une représentation symbolique d’une transformation chimique qui permet:
- de préciser la formule chimique des réactifs et des produits
- de préciser les proportions dans lesquelles les réactifs sont consommés et les produits sont formés.
Voici la méthode l’on peut suivre pour écrire une équation de réaction correcte qualifiée d’ “équilibrée” ou “d’ajustée”:
- Première étape
Reprendre l’écriture de la réaction chimique et rempacer les noms des réactifs et des produits par leur formule chimique.
Exemple avec la combustion du méthane:
méthane + dioxygène → dioxyde de carbone + eau
CH4 + O2 → CO2 + H2O
- Deuxième étape
L’équation doit être ajustée en ajoutant des coefficients stoechiométriques.
Un coefficient stoechiométique est un nombre que l’on ajoute devant une formule chimique afin de modifier le nombre d’entités chimiques qui interviennent.
Par défaut, l’absence de coefficient stoechiométrique noté devant une formule équivaut à un coefficient “1”
Pour l’instant, l’équation de réaction CH4 + O2 → CO2 + H2O indique qu’une molécule de méthane réagit avec une molécule de dioxygène pour former une molécule de dioxyde de carbone et une molécule d’eau.
Les coefficients que l’on va ajouter permettent de traduire la conservation des éléments chimiques et de la charge électrique.
Pour traduire la conservation des éléments on commence par faire un bilan des différents éléments présents.
Dans le cas de la combustion du méthane on trouve par exemple:
- du carbone (C)
- de l’hydrogène (H)
- de l’oxygène (O)
On réalise un décompte du nombre total d’éléments de chaque sorte d’une part dans les réactifs et d’autre part dans les produits.
Exemple pour la combustion du méthane:
- Carbone (C) : 1 dans les réactifs (CH4) et un dans les produits (CO2 )
- Hydrogène (H): 4 dans les réactifs (CH4 ) et 2 dans les produits (H2O)
- Oxygène (O): 2 dans les réactifs (O2) et 3 dans les réactifs (deux dans CO2 plus un dans H2O)
On ajuste ensuite progressivement, à tour de rôle, chaque élément en tenant compte des modifications que provoquent les coefficients sur les autres éléments.
Ajustement du carbone: le bilan montre qu’il y a déjà équilibre (un de chaque coté) donc il n’y a pas de modification à apporter:
CH4 + O2 → CO2 + H2O
Ajustement de l’hydrogène: le décompte montre qu’il faudrait deux fois plus d’hydrogène dans les produits pour arriver à un total de “4” comme dans les produits. Pour arriver à ce total de “4” hydrogène dans les produits on peut multiplier par “2” le nombre de molécules d’eau qui contiennent chacune deux hydrogène. L’équation devient:
CH4 + O2 → CO2 + 2 H2O
Avec cet ajustement le nombre d’élements oxygène dans les produits passe à 2 + 2 = 4 ( 2 dans la molécule de dioxyde de carbone et 2 dans les deux molécules d’eau).
Pour ajuster l’oxygène il faudrait multiplier le nombre d’oxygène dans les réactifs par deux en ajoutant un coefficient stoechiométrique “2” devant la molécule de dioxygène:
CH4 + 2 O2 → CO2 + 2 H2O
- Troisième étape
Vérifier que la charge totale se conserve et si nécessaire modifier les coefficients pour qu’elle soit respectée.
Dans le cas de la combustion du méthane toutes les espèces chimiques sont neutres par consequént la conservation de la charge est bien repsectée (elle est nulle pour les réactifs et les produits)
Voir fiche de cours “Ecrire et équilibrer une équation de réaction“
Espèce chimique spectatrice
Définition
Une espèce chimique est dite spectatrice si elle est présente dans le système chimique pendant la transformation chimique mais qu’elle n’intervient ni en tant que réactif ni en tant que produit.
Une espèce chimique spectatrice peut avoir une influence sur la transformation chimique, elle peut la favoriser, l’accélérer ou au contraire la défavoriser, la ralentir mais elle ne participent pas et on ne la fait pas figurer dans la réaction ou l’équation de réaction.
Exemple
Lors de la combustion du méthane dans l’air le système chimique comporte non seulement le méthane et le dioxygène de l’air mais aussi les autres constituants de cet air: le diazote et les gaz présents en faibles proportions (argon, dioxyde de carbone…)
Le diazote et ces autres gaz constituent des espèces chimiques spectatrices de la réaction de combustion du méthane.
la stoechiométrie
La stoechiométrie désigne l’ensemble coefficients stoechiométriques qui permettent d’ajuster une équation de réaction.
Ces coefficients indiquent les proportions dans lesquelles les réactifs sont consommés et les produits sont formés.
Exemple de la réaction de combustion du méthane:
CH4 + 2 O2 → CO2 + 2 H2O
- On peut lire cette équation en terme d’entités chimiques: une molécule de méthane réagit avec deux molécules de dioxygène pour former une molécules de dioxyde de carbone et deux molécules d’eau.
- On peut aussi interpréter cette équation en terme de quantité de matière: une mole de méthane réagit avec deux moles de dioxygène pour former une mole de dioxyde de carbone et deux moles d’eau.
- Cette équation permet de comparer les proportions des réactifs consommés: la quantité de dioxygène consommée est deux fois plus élevée que celle de méthane.
- Cette équation permet de comparer les proportions de produits formés: il se forme deux fois plus d’eau que de dioxyde de carbone.
- Cette équation permet de comparer les réactifs consommés et les produits formés: la quantité de dioxyde de carbone formé est égale à celle de méthane consommé mais elle est deux fois plus faible que celle de dioxygène consommé. La quantité d’eau formée est égale à celle de dioxygène consommé et elle est deux fois plus élevée que celle de méthane consommée.
Voir fiche de cours “Stoechiométrie“
Quelques équations à savoir écrire et équilibrer
- Combustion du méthane
Voir exemple décrit dans le paragraphe précédent:
CH4 + 2 O2 → CO2 + 2 H2O
- Combustion du carbone
Le carbone réagit avec le dioxygène et produit du dioxyde de carbone
Réaction:
Carbone + dioxygène → dioxyde de carbone
Equation de réaction:
C + O2 → CO2
Cette équation est déjà ajustée, il n’est pas nécessaire d’ajouter de coefficient stoechiométrique.
- Réaction entre l’acide chlorhydrique et le fer
Les ions hydrogène (présents dans dans l’acide chlorhydrique) réagissent avec les atomes de fer pour former des ions fer II et du dihydrogène. Les ions chlorure, aussi présents dans l’acide chlorhydrique, sont des espèces chimiques spectatrices.
Equation de réaction non ajustée:
H+ + Fe → H2 + Fe2+
Ajustement de l’élément hydrogène:
2 H+ + Fe → H2 + Fe2+
L’élément fer est déjà ajusté
La charge totale des réactifs est 2 x (+) + 0 = 2+
La charge totale des produits est 0 + 1 x (2+) = 2+
La conservation de la charge est respectée.
L’équation équilibrée est donc:
2 H+ + Fe → H2 + Fe2+
- Réaction entre l’acide chlorhydrique et le calcaire
Il y a réaction entre les ions hydrogène de l’acide chlorhydrique et les ions carbonate du calcaire. Il se forme de l’eau et du dioxyde de carbone. Les ions chlorure de l’acide et les ions calcium du calcaire jouent le rôle d’espèces chimiques spectatrices.
Equation de réaction non ajustée:
H+ + CO32- → CO2 + H2O
Ajustement de l’élément hydrogène:
2 H+ + CO32- → CO2 + H2O
L’élément oxygène est déjà ajusté
La charge totale est nulle pour les réactifs ( 2 charges positives pour les deux ions hydrogène compensées par deux charges négatives portées par un ion carbonate)
La charge totale est aussi nulle pour les produits (chaque produit est neutre)
La conservation de la charge électrique est respectée.
2 H+ + CO32- → CO2 + H2O est donc une équation ajustée.
- Réaction entre l’acide chlorhydrique et l‘hydroxyde de sodium
Il y a réaction entre les ions hydrogène de l’acide chlorhydrique et les ions hydroxyde de l’hyroxyde de sodium et il se forme de l’eau. Les ions chlorure (dans l’acide chlorhydrique) et les ions sodium (dans l’hydroxyde de carbone) jouent le rôle d’espèces chimiques spectactrices.
Equation de réaction:
H+ + OH– → H2O
L’élément hydrogène est conservé
L’élément oxygène est conservé
La charge totale est conservée (elle est globalement nulle dans les réactifs et les produits)
H+ + OH– → H2O est donc une équation ajustée
Le réactif limitant
Si les proportions des réactifs utilisés pour une transformation chimique coïncident avec les proportions des coefficients stoechiométriques alors la totalité des réactifs est consommée: lorsque la transformation chimique est finie la quantité des espèces chimiques jouant le rôle de réactif est nulle.
Par exemple, pour la combustion du méthane:
CH4 + 2 O2 → CO2 + 2 H2O
Si le mélange initial contient deux fois plus de dioxygène que de méthane alors en fin de réaction il ne reste ni méthane ni dioxygène.
Si ces proportions ne sont pas repectées alors l’un des réactifs est en excès et l’autre est limitant
Définition
Le réactif limitant est celui qui est totalement consommé à la fin d’une transformation chimique.
Par conséquent la quantité de matière du réactif limitant est nulle en fin de réaction alors que ce n’est pas le cas pour les autres réactifs.
On peut aussi identifier le réactif limitant à partir des quantités de matière initiales et des coefficients stoechimétriques.
Si l’équation de réaction est de la forme suivante:
aA + bB → cC +dD
C’est à dire qu’un nombre “a” d’espèces chimiques “A” réagit avec un nombre “b” d’espèces chimiques “B” pour former un nombre “c” d’espèces chimiques C et un nombre “d” d’espèces chimiques D.
La réaction se fait entre une quantité initiale (en mole) ni(A) d’espèce A et une quantité initiale ni(B) de l’espèce B.
Pour identifier le réactif limitant on calcul pour chaque réactif le rapport de la quantité de matière initiale divisée par coefficient stoechiométrique.
Pour le réactif A on calcule:
ni(A)
a
Pour le réactif B on calcule:
ni(B)
b
On compare ensuite ces rapports:
Si 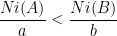 alors le réactif limitant est A.
alors le réactif limitant est A.
Si 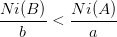 alors le réactif limitant est B.
alors le réactif limitant est B.
Par exemple pour réaliser la combustion du méthane on mélange 1,5 mol de méthane et 2,2 mol de dioxygène.
L’équation de réaction est
CH4 + 2 O2 → CO2 + 2 H2O
Pour le méthane (coefficient stoechiométrique 1):
ni( CH4) = 1,5 = 1,5 mol
1 1
Pour le dioxygène (coefficient stoechiométrique 2):
ni( O2 ) = 2,2 = 1,1 mol
2 2
D’après ces résultats
ni( O2 ) < ni( CH4)
2 1
Conclusion: le dioxygène est le réactif limitant.
Dans les conditions prises pour cet exemple, lorsque le combustion s’arrête le dioxygène a totalement disparu mais il reste du méthane.
Transformations chimiques endothermiques et exothermiques
Définitions
Une transformation chimique est dit exothermique si elle libère de l’énergie thermique.
Une transformation chimique est dit endothermique absorbe de l’énergie thermique.
Lors d’une transformation chimique exothermique le système chimique composé des réactifs et des produits cède de l’énergie thermique (Q<0). Cette énergie est reçue par le milieu où la transformation se réalise ce qui provoque une augmentation de sa température:
plus la masse des réactifs consommés est grande et plus l’énergie thermique libérée l’est aussi et s’accompagne d’une augmentation de température importante.
Inversement, si une transformation chimique est endothermique alors l’énergie thermique est absorbée par le système chimique (Q>0). Cette énergie thermique est prélevée dans le milieu où se déroule la transformation qui voit sa température diminuer:
plus la masse de réactifs consommés est grande et plus l’énergie thermique absorbée l’est aussi et s’accompagne d’une diminution de température importante.
Voir fiche de cours “Transformations chimiques exothermiques et endothermiques”
Synthèse chimique
Il est possible d’exploiter les transformations chimiques pour obtenir des espèces chimiques ayant un intérêt particulier ( principe actif, désinfectant, conservateur alimentaire, produit cosmétique, colorant etc), dans ce cas on réalise une synthèse chimique.
Définition
Une synthèse chimique est la production d’une espèce chimique donnée grâce à une transformation chimique.
Elle permet de reproduire des espèces chimiques existant dans la nature mais sans exploiter (et parfois épuiser) des ressources naturelles et à un coût souvent nettement moins élevé.
Les transformations chimiques peuvent se dérouler naturellement (oxydation des métaux, combustion, photosynthèse…) mais on ne parle de synthèse que lorsqu’elles sont provoquée de manière maîtrisée par l’homme.
Une synthèse comporte toujours les étapes suivantes:
- Prélever la quantité adaptée de chaque réactif (en général par pesée pour les solides et par mesure de volume pour les liquides)
- Réalisation de la transformation chimique (souvent en utilisant un chauffage à reflux pour accélérer la transformation sans avoir de perte de matière)
- Isolement, extraction du produit ( il faut extraire l’espèce chimique du milieu réactionnel et la séparer des réactifs qui restent, des autres produits, du solvant…)
- Caractérisation du produit ( il faut s’assurer par des tests physiques ou chimiques que l’espèce chimique obtenue est bien celle souhaitée et vérifier qu’elle présente un degré de pureté acceptable)
Le chauffage à reflux
Les transformations chimiques se réalisent en général plus rapidement lorsqu’on chauffe le milieu réactionnel mais ce chauffage risque de provoquer une perte de matière lorsque les réactifs, le solvant ou les produits sont volatiles. Ils risquent de se vaporiser avec comme inconvénient:
- de diminuer le rendement de la synthèse (on obtient moins de produits que prévu)
- de libérer dans l’air des espèces chimiques qui peuvent être nocives.
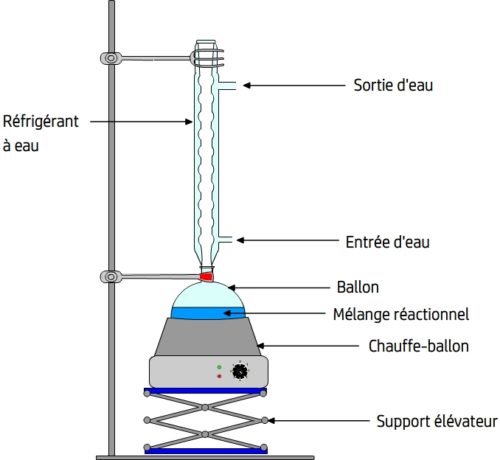
Pour chauffer le mélange réactionnel tout en limitant la perte de matière on réalise un chauffage à reflux.
Ce montage qui permet de réaliser un chauffage à reflux comporte:
- Un ballon qui contient le système chimique (solvant, réactifs..) et dont la forme favorise un chauffage uniforme.
- Un chauffe-ballon qui est le système de chauffage adapté au ballon.
- Un réfrigérant à eau qui dispose d’une arrivée d’eau et d’une sortie d’eau.
- Un support élévateur qui permet d’adapter le ballon au réfrigérant.
Lorsque le mélange réactionnel est chauffé le mélange réactionnel tend à se vaporiser. Les vapeurs s’élèvent dans le réfrigérant à eau et se liquéfient au contact des parois refroidies par le courant d’eau froide. Le liquide ainsi formé retombe dans le milieu réactionnel (c’est le reflux !)
La chromatographie
C’est une technique courante qui permet:
- de vérifier que l’espèce chimique obtenue est pure
- de confirmer la nature de l’espèce chimique synthétisée
Principe
- L’échantillon à analyser est déposé sur une plaque de chromatographie (la phase fixe), plus précisément sur une ligne de dépôt tracée en bas de cette plaque. Sur cette ligne de dépôt on dépose aussi une ou plusieurs gouttes de corps pur de l’espèce chimique de référence.
- La partie inférieure de la plaque de chromatographie est immergée dans un liquide (appelé éluant) qui est absorbé par la plaque. Ce liquide entraîne avec lui les espèces chimiques déposées à des vitesses différentes.
- La plaque de chromatographie est retirée de l’éluant avant que celui n’atteigne la partie supérieur.
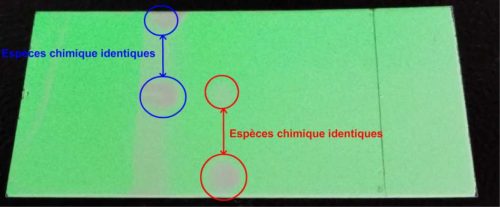
- Cette plaque et les tâches qu’elle comporte (taches visibles où à révéler) constituent le chromatogramme
- Si l’échantillon à analyser se décompose en plusieurs tâches alors cet échantillon est un mélange par contre s’il n’y en a qu’une seule il s’agit d’un corps pur.
- Si l’échantillon à analyser forme une tache au même niveau que le corps pur de référence alors la nature chimique de l’espèce chimique synthétisée est confirmée.
Voir fiche de cours “La chromatographie“
Les autres cours de physique-chimie niveau seconde
- Corps purs et mélanges au quotidien
- Les solutions aqueuses, un exemple de mélange
- Du macroscopique au microscopique, de l’espèce chimique à l’entité
- Le noyau de l’atome, siège de sa masse et de son identité
- Le cortège électronique de l’atome définit ses propriétés chimiques
- Vers des entités plus stables chimiquement
- Transformation physique
- Transformation chimique
- Transformation nucléaire
- Décrire un mouvement
- Modéliser une action sur un système
- Principe d’inertie
- Emission et perception d’un son
- Vision et image
- Circuits électriques
- Capteurs