Cours de physique – niveau classe de première S – partie « Lois et modèles – Cohésion et transformations de la matière »
- Qu’est-ce qu’une liaison hydrogène ?
- Conditions d’existence des liaisons hydrogènes
- Représentation des liaisons hydrogène
- Exemples de liaison hydrogène dans l’éthanol
- Liaisons hydrogène dans l’eau
- Intensité des liaisons hydrogène
- Comparaison des liaisons hydrogène et des autres liaisons
- Influence des liaisons hydrogène sur la solubilité d’un corps pur dans l’eau
- Influence des liaisons hydrogène sur les températures de changement d’état
Qu’est-ce qu’une liaison hydrogène ?
Il s’agit d’une liaison intermoleculaire entre molécules identiques d’un corps pur ou entre molécules différentes d’un mélange.
Elle correspond à une interaction globalement attractive entre un atome d’hydrogène portant une forte charge partielle positive et un autre atome très électronégatif.
Conditions d’existence des liaisons hydrogènes
Des liaisons hydrogène peuvent s’établir entre deux molécules à deux conditions.
Condition 1
L’une des molécules doit comporter un atome d’hydrogène porté par atome suffisamment électronegatif.
Si la liaison hydrogène – atome est polarisée, donc si l’électronégativité de ce dernier est au moins de 2,60, alors on peut considérer cette condition est respectee. Par conséquent les hydrogène pouvant établir des liaisons hydrogène sont par exemple ceux des liaisons suivantes:
- Oxygène – Hydrogène O-H
- Azote – Hydrogène N-H
- Chlore – Hydrogène Cl-H
- Brome – Hydrogène Br-H
- Iode – Hydrogène I-H
Condition 2
L’une des molécules doit comporter un atome assez électronégatif portant au moins un doublet non liant.
Cet atome peut-être :
- L’oxygène O
- L’azote N
- Le fluor F
- Le chlore Cl
- Le brome Br
- L’iode I
Remarque
L’atome électronégatif portant au moins un doublet non liant peut aussi être celui qui porte l’hydrogène de la liaison (c’est par exemple le cas pour les liaison hydrogène-oxygène ou hydrogène azote) Il est par exemple suffisant qu’un groupe hydroxyle -O-H soit présent dans un corps pur pour qu’une liaison hydrogène puisse s’y établir.
Représentation des liaisons hydrogène
Elles sont représentées par des pointillés reliant l’hydrogène et l’atome électronégatif avec lequel il est en interaction
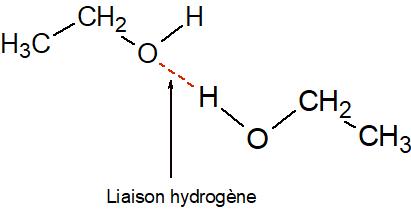
Exemples de liaison hydrogène dans l’éthanol
L’éthanol ( de formule C2H6O) porte une fonction hydroxyle -O-H, l’hydrogène de cette fonction peut établir une liaison hydrogène avec l’oxygène d’une autre molécule d’éthanol.
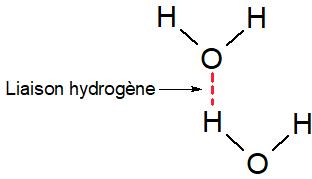
Liaisons hydrogène dans l’eau
Une molécule d’eau (H2O) comporte deux hydrogène susceptibles d’établir chacun une liaison hydrogène avec l’oxygène d’une autre molécule d’eau
Intensité des liaisons hydrogène
Ces liaisons sont d’autant plus intenses que:
- les hydrogène de la liaison sont portés par des atomes électronégatifs.
- les atomes en interaction avec l’hydrogène sont électronégatifs.
- que les hydrogène et atomes électronégatifs susceptibles d’interagir sont nombreux.
Comparaison des liaisons hydrogène et des autres liaisons
À l’exception des liaisons ioniques les liaisons hydrogène sont les liaisons interprète images les plus intenses.
Elles sont en particulier plus intenses que:
- les liaisons de Van der Waals entre dipôles permanents.
- les liaisons de Van der Waals entre dipôles instantanés.
Influence des liaisons hydrogène sur la solubilité d’un corps pur dans l’eau
En règle générale la solubilité d’un corps dans l’eau est favorisée par l’établissement de liaisons hydrogène entre les molécules de ce corps pur et celle de l’eau.
Les molécules d’eau établissent en effet de fortes liaisons hydrogène entre elles et les molécules d’un soluté ne peuvent s’y disperser que si elles sont elles capables d’exercer des interactions attractives leur permettant de s’entourer de molécules d’eau. Parmi les interactions soluté-molecule d’eau possibles permettant ce phénomène on peut citer:
- le port de charge électrique (le soluté est ionique)
- la polarisation des molécules de soluté
- la possibilité d’établir des liaisons hydrogène
Influence des liaisons hydrogène sur les températures de changement d’état
Les liaisons hydrogène font partie des interactions intermoléculaires attractives qui maintiennent en contact les molécules d’un solide ou d’un liquide.
Pour que les molécules d’un solide puissent devenir mobile (fusion) ou que les molécules d’un liquide puissent s’affranchir d’un contact avec leurs voisines (vaporisation) il est nécessaire que l’énergie thermique (qui reflète l’agitation des molécules) soit suffisante pour vaincre les interactions attractives. Or l’énergie thermique d’un corps dépend de sa température par conséquent :
Plus les liaisons hydrogène qui s’établissent entre les molécules d’un corps pur sont intenses et nombreuses, plus les températures de fusion et d’ébullition de ce corps pur sont élevées
Notions de seconde à réviser
- L’atome
- La charge électrique
- Les éléments chimiques
- Le tableau périodique
- Température de fusion d’une espèce chimique
- Température d’ébullition d’une espèce chimique
Autres cours du thème “Lois et modèles – Cohésion et transformations de la matière“
