Cour de physique-chimie | Première spécialité
Ce cours correspond à la partie ” Détermination de la composition du système initial à l’aide de grandeurs physiques ” du programme de physique-chimie de première spécialité.
Il est situé dans la partie du programme ” Constitution et transformations de la matière – Suivi de l’évolution d’un système, siège d’une transformation – Détermination de la composition du système initial à l’aide de grandeurs physiques“
- Rappels sur les notions de mole et de quantité de matière
- Nombre d’Avogadro et quantité de matière
- La masse molaire atomique
- La masse molaire moléculaire
- Relation entre masse et quantité de matière
- Quantité de matière d’un corps pur solide
- Quantité de matière d’un corps pur liquide
- Quantité de matière d’un gaz
- La concentration en masse
- La concentration en quantité de matière
- Préparer une solution aqueuse
- Trouver une concentration grâce à l’absorbance
A réviser – Les autres cours de première spécialité – Pour approfondir et découvrir
1. Rappels sur les notions de mole et de quantité de matière
Un nombre d’entités chimiques (atomes, molécules, ions) peut être exprimé de deux manières différentes :
- De manière directe, en notant « N » le nombre d’entités chimiques, on peut alors par exemple dire que 24 g de carbone contient 1,204 x 1024 atomes de carbone en notant NC = 1,204 x 1024 atomes
- En utilisant une grandeur appelée « quantité de matière » dont l’unité est la mole (de symbole «mol »), on peut alors par exemple dire que 24 g de carbone contient 2,0 moles d’ atomes de carbone en notant nC = 2,0 mol
La mole est un ensemble constitué de 6,02 x 1023 entités chimiques toutes identiques.
Exemples :
- Dans une mole d’atomes de fer il y a 6,02 x 1023 atomes de fer
- Dans une mole de molécules d’eau il y a 6,02 x 1023 molécules d’eau
- Deux moles de molécules de méthane correspond à 2 x 6,02 x 1023 =1,204 x 1024 molécules de méthane.
Une quantité de matière est une grandeur que l’on exprime en mole et qui se note avec la lettre « n »
Voir aussi:
2. Nombre d’Avogadro et quantité de matière
Le chimiste italien Amedeo Avogadro a défini un nombre qui fut appelé en son hommage « Nombre d’Avogadro ». Ce nombre, noté « NA », a pour valeur 6,02 x 1023. Ce nombre coïncide avec le nombre d’entités dans une mole.
Nombre d’ Avogadro : NA = 6,02 x 1023
Le nombre d’Avogadro permet d’exprimer facilement la relation entre un nombre d’entités chimiques « N » et une quantité de matière « n » : il correspond au facteur de proportionnalité entre ces deux grandeurs d’où la formule suivante :
N = n x NA
Dans cette formule :
- N est un nombre d’entités chimiques (nombre d’atomes ou de molécules, ou d’ions…)
- n est la quantité de matière en mole (mol)
- NA est le nombre d’Avogadro (qui vaut NA = 6,02 x 1023 )
Exemple
Un morceau de fer est constitué de 4,8 mol d’atomes de fer par conséquent le nombre d’atomes de fer est :
N = n x NA
= 4,8 x 6,02 x 1023
= 2,9 x 1024 atomes
Il est aussi possible de modifier la relation précédente pour exprimer la quantité de matière en fonction du nombre d’entités chimiques, on en tire alors la formule suivante :
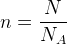
Exemple
Un gaz contient 5,0568 x 1024 molécules de dioxyde de carbone, la quantité de matière correspondante est donc :
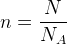
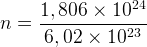
n = 8,40 mol
Voir aussi cours “La mole“
3. La masse molaire atomique
Définition
La masse molaire atomique est la masse possédée par une mole d’atomes ( 6,02 x 1023 atomes) tous identiques (même numéro atomique Z et même nombre de nucléons A).
La masse molaire atomique est notée « M » (avec éventuellement le symbole atomique mentionné entre parenthèses ou en indice) et son unité est le gramme par mol (g.mol-1)
Etant donné que la masse d’un nucléon (proton ou neutron) est d’environ mn = 1,67 x 10-27 kg, la masse d’une mole de nucléons est donc de :
mn x NA = 1,67 x 10-27 x 6,02 x 1023
= 1,00.10-3 kg
La masse d’une mole de nucléons est de 1,00 g
La conséquence de ce résultat est que :
- si le noyau d’un atome comporte 5 nucléons alors une mole de cet atome contient 5 mol de nucléons et a une masse de 5 g
- si le noyau d’un atome comporte 26 nucléons alors une mole de cet atome contient 26 mol de nucléons et a une masse de 26 g
- plus généralement une mole d’un atome avec un nombre «A » de nucléons dans son noyau aura une masse de « A » grammes
Le nombre de masse « A » d’un noyau correspond aussi à la masse molaire de l’atome exprimée en g.mol-1
Pour connaître la masse molaire atomique d’un atome il suffit donc de chercher son nombre de masse dans le tableau périodique.
Voir aussi cours
4. La masse molaire moléculaire
Définition
La masse molaire moléculaire d’une espèce chimique moléculaire correspond à la masse d’une mole de molécules appartenant à cette espèce chimique.
La masse molaire moléculaire se note « M » (avec éventuellement la formule chimique de l’espèce mentionnée entre parenthèse ou en indice) et son unité est le gramme par mole de symbole g.mol-1.
Pour calculer la masse molaire moléculaire d’une espèce chimique il suffit d’additionner la masse molaire atomique de tous les atomes qui constituent cette molécule.
Pour effectuer ce calcul on se base en général sur la formule brute.
Pour une espèce chimique de formule générale AaBbCc, alors on déduit qu’il s’agit d’une molécule composée :
- d’un nombre « a » d’élément « A »
- d’un nombre « b » d’élément « B »
- d’un nombre « c » d’élément « C »
Sa masse molaire M( AaBbCc ) = a x M(A) + b x M(B) + c x M(C)
Ce sera sans doute plus simple à comprendre avec des exemples
Exemples
- Masse molaire moléculaire de l’eau de formule H2O :
M(H2O) = 2 x M(H) + M(O)
M(H2O) = 2 x 1 + 16
M(H2O) = 18 g.mol-1
La masse molaire moléculaire de l’eau est donc de 18 grammes par mole
- Masse molaire de l’acide éthanoïque de formule C2H4O2:
M (C2H4O2) = 2 x M(C) + 4 x M(H) + 2 x M(O)
M (C2H4O2) = 2 x 12 + 4 x 1 + 2 x 16
M (C2H4O2) = 60 g.mol-1
La masse molaire moléculaire de l’acide éthanoïque est donc de 60 grammes par mole
Voir aussi cours “La masse molaire”
5. Relation entre masse et quantité de matière
Si un corps pur de quantité de matière « n » possède une masse molaire « M » alors sa masse «m » correspond au produit de la quantité de matière par la masse molaire, ce qui peut se traduire par la formule suivante :
m = M x n
où:
- n est la quantité de matière exprimée en mole (mol)
- M est la masse molaire exprimée en gramme par mole (g.mol-1)
- m est la masse du corps en gramme (g)
Il est possible, à partir de la formule précédente, d’obtenir une relation qui permet de calculer la quantité de matière :
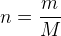
On peut aussi exprimer la masse molaire en fonction de la masse et de la quantité de matière :
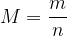
Voir aussi cours “La masse molaire”
6. Quantité de matière d’un corps pur solide
Il est possible de trouver la quantité de matière d’un corps pur solide à partir de la méthode suivante.
- Etape 1 : Déterminer la masse « m » du corps à l’aide d’une balance.
- Etape 2 : Déterminer la masse molaire « M » de l’espèce chimique.
- Etape 3 : Utiliser la relation
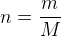 afin de déterminer la quantité de matière « n »
afin de déterminer la quantité de matière « n »
Voir aussi cours “La masse molaire”
7. Quantité de matière d’un corps pur liquide
Il est possible de trouver la quantité de matière d’un corps pur liquide à partir de la méthode suivante.
- Etape 1 : Déterminer le volume « V » du liquide à l’aide d’une éprouvette graduée.
- Etape 2 : Déterminer la masse « m » en exploitant la relation m = ρ x V
- Etape 3 : Déterminer la masse molaire « M » de l’espèce chimique.
- Etape 4 : Utiliser la relation
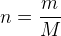 afin de déterminer la quantité de matière « n »
afin de déterminer la quantité de matière « n »
Voir aussi cours “La masse molaire”
8. Quantité de matière d’un gaz
Le volume d’un gaz est plus facilement mesurable que sa masse et c’est de préférence ce dernier que l’on exploite pour exprimer la quantité de matière d’un corps gazeux.
La loi d’Avogadro-Ampère établit que des volumes égaux de gaz contiennent toujours la même quantité de matière : à une température et sous une pression données un volume contient toujours la même quantité de matière de gaz qui ne dépend pas de sa nature ( un litre de dioxyde de carbone comporte la même quantité de matière qu’un litre de dioxygène ou qu’un litre de méthane ou qu’un litre d’ozone…)
Le volume molaire des gaz est noté Vm, il correspond au volume occupé par une mole de gaz à une température et à une pression données, il s’exprime en litre par mol (L.mol-1)
à Retenir :
Sous pression atmosphérique Vm = 22,4°L.mol-1 à 0°C et Vm = 24,0 L.mol-1 à 20°C
La quantité de matière d’un gaz est peut être calculé grâce à la relation suivante :
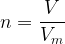
où :
- n est la quantité de matière du gaz en mole (mol)
- V est le volume du gaz en litre (L)
- Vm est le volume molaire en Litre par mol (L.mol-1)
On peut aussi exprimer le volume du gaz par la relation suivant:
V = n x Vm
On peut aussi exprimer le volume molaire :
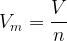
Voir aussi cours “La masse molaire”
9. La concentration en masse
La concentration en masse aussi appelée concentration massique exprime la proportion de masse de soluté dissous dans une solution aqueuse.
Elle correspond au rapport de la masse de soluté par le volume de la solution aqueuse et peut s’exprimer grâce à la relation suivante :
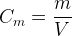
où :
- Cm est la concentration massique du soluté en gramme par mole (g.mol-1)
- m est la masse de soluté dans la solution en gramme (g)
- V est le volume de la solution en litre (L)
Il est possible de tirer de la formule précédente une relation qui permet d’exprimer la masse de soluté :
m = Cm x V
Il est aussi possible d’exprimer le volume de solution :
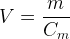
10. La concentration en quantité de matière
On l’appelle aussi concentration molaire ou juste « concentration », elle exprime la proportion de quantité de soluté par rapport au volume de la solution.
Elle se note «C » et l’on précise parfois le nom ou la formule du soluté entre parenthèses ou en indice. Son unité est la mole par litre (symbole mol.L-1)
Par exemple la concentration en diiode peut se noter C(diiode) ou C(I2) ou Cdiiode ou encore CI2
La concentration molaire d’un soluté est définie comme le rapport de la quantité de matière du soluté par le volume de la solution.
Elle peut s’exprimer par la relation suivante :
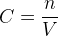
où :
- C est la concentration d’un soluté donné en mole par litre (mol.L-1)
- n est la quantité de matière du soluté en mole (mol)
- V est le volume de la solution en litre (L)
Il est aussi possible d’exprimer la concentration en quantité de matière « C » à partir de la concentration en masse Cm.
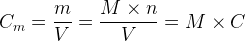
Donc :
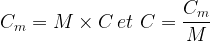
La concentration permet d’exprimer la quantité de matière d’un soluté :
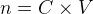
On peut aussi exprimer un volume de solution :
Voir aussi cours ” Concentration molaire d’une solution“
11. Préparer une solution aqueuse
Pour préparer une solution de concentration C :
- Etape 1 :Choisir une fiole jaugée ayant une contenance de volume V
- Etape 2 : Déterminer la quantité « n » de soluté à dissoudre à partir de la relation n = C x V
- Etape 3 : Déterminer la masse « m » de soluté à partir de la relation m = n x M
- Etape 4 : Peser une masse « m » de soluté avec une balance puis introduire le soluté dans la fiole jaugée
- Etape 5 : ajouter progressivement le solvant (en général l’eau), en agitant régulièrement, jusqu’au trait de jauge de la fiole.
12. Trouver une concentration grâce à l’absorbance
La concentration d’une solution permet de déterminer la quantité de matière qu’elle contient, il est donc important de pouvoir déterminer cette grandeur. L’une des méthodes possibles consiste à exploiter une grandeur appelée « absorbance »et la loi de Beer-Lambert.
L’absorbance, notée A est une grandeur sans unité, elle reflète l’absorption d’un rayonnement d’une longueur d’onde donnée par une solution : plus l’absorbance est élevée et plus une solution absorbe le rayonnement.
L’absorbance d’une solution de peut être exprimée grâce à la loi de Beer-Lambert :
A = ε.d.c
où :
- A est l’absorbance (sans unité)
- ε est le coefficient d’extinction molaire en litre par mol et par centimètre (L.mol-1.cm-1)
- d est la distance sur laquelle le rayonnement se propage dans la solution (en général la largeur de la cuve du spectrophotomètre) en centimètre (cm)
- c est la concentration molaire ( mol.L-1)
A partir de cette loi on peut exprimer la concentration par la relation :
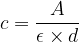
Si l’absorbance, le coefficient d’extinction molaire et la largeur « d » sont connues alors il est possible d’en déduire la concentration à partir de la formule précédente.
Il est aussi possible d’exploiter expérimentalement la proportionnalité entre absorbance et concentration en réalisant une courbe d’étalonnage à partir de solutions de concentration connue. Le principe est le suivant :
- Préparer trois ou quatre solutions aqueuses de concentrations connues.
- Mesurer, à l’aide d’un spectrophotomètre l’absorbance de ces solutions.
- Tracer le graphique représentant l’absorbance en fonction de la concentration A = f(C). On doit obtenir une droite passant par l’origine)
- Mesurer l’absorbance de la solution de concentration inconnue
- Déterminer la concentration à partir de l’absorbance mesurée et de la droite tracée (la concentration correspond l’abscisse du point ayant la valeur de l’absorbance mesurée)
Voir aussi cours:
A réviser
Cours de seconde “Les solutions aqueuses“:
- définit la notion de solution aqueuse et le vocabulaire usuel (soluté, solvant…)
- définit la notion de concentration en masse et donne la formule qui permet de la calculer.
- donne la méthode à suivre pour préparer une solution aqueuse de concentration connue.
Cours de seconde “Compter les entités dans un échantillon de matière“:
- Définition de la mole
- Définition de la quantité de matière
- Méthode pour calculer la masse d’une entité chimique
- Méthode pour calculer la quantité de matière d’un échantillon
“Mole et quantité de matière” Fiche détaillée présentant les relations entre ces deux grandeurs.
“Masse des entités chimiques” – Fiche détaillée présentant la méthode à suivre pour calculer la masse d’un atome, d’une molécule, d’un ion monoatomique ou polyatomique.
Les autres cours de première spécialité
- Quantité de matière, masse molaire et concentration
- Réaction d’oxydoréduction et avancement
- Titrage colorimétrique redox
- Schéma de Lewis, géométrie, électronégativité et polarisation
- Cohésion des solides, dissolution, solubilité, hydrophilie et lipophilie
- Structure et nomenclature des espèces organiques
- Synthèse organique
Pour approfondir et découvrir
“Les solutions aqueuses” – Fiche détaillée sur les solutions aqueuses
“Echelle de teinte” – Méthode expérimentale pour déterminer une concentration massique à partir d’une échelle de teinte
“La mole” (Laboratoire National de Métrologie et d’essais) – Définitions officielles actuelles et passées de la mole
“Défis sur la notion de mole” – Document au format pdf de l’académie d’Orléan proposant différents défis autour de la quantité de matière, de la mole et de la masse. (Document professeur avec les énoncés et des propositions de corrections)