La molécule de diiode
Le diiode est un corps simple dont les molécules de formule brute I2 sont composées de deux atomes d’iode associés par une liaison covalente non polarisée.
Représentation de Lewis d’une molécule de diode
![]()
L’état physique du diiode
A température ambiante le diode se présente sous forme d’un solide grisâtre aux reflets métalliques violets. Sa température de fusion est de 113,7 °C et sa température d’ébullition de 184,4°C mais lorsqu’on chauffe du diode solide il tend en pratique à se sublimer, il passe directement à l’état gazeux en formant des vapeurs violettes irritantes et réactives (mais un peu moins que les autres dihalogènes).
La solubilité
Le diode étant une molécule apolaire (pas de moment dipolaire permanent) sa solubilité est plus importante dans des solvants apolaires ou peu polaires tels que le le cyclohexane ou le dichlorométhane. Sa solubilité est nettement plus faible dans des solvants polaire tels que l’eau. Exemples: la solubilité du diode (à 25°C) est de 330 mg/L dans l’eau et de 28 g/L dans le cyclohexane.
La couleur des solutions de diiode
Les couleurs des solutions de diode sont très différentes selon le solvant utilisé, avec l’eau on obtient un jaune très pâle, du rose avec le cyclohexane et rouge-bordeaux dans le dichlorométhane.
Solution de diiode dans du cyclohexane

Solution de diiode dans du dichlorométhane

L’eau iodée
Il est possible d’augmenter la solubilité du diode en utilisant une solution contenant des ions iodures (formule I–). En effet, le diode se combine (on dit qu’il y a complexation) avec ces derniers pour former des ions triiodure de formule I3– selon l’équilibre: I2 + I– 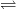 I3–
I3–
La solution ainsi obtenu est appelée eau iodée ou solution de Lugol et possède une couleur orangée.
Eau iodée

Couples oxydo-reducteurs
– Le couple I2/I–
Le diode y joue le rôle d’oxydant et peut être réduit en ion iodure suivant la demi-équation:
I2(aq) + 2 e– → 2I–
Son potentiel standard est E° = 0,62 V
– Le couple IO3– /I2
Le diode y joue le rôle d’un réducteur qui peut être oxydé en ion iodate suivant la demi-équation:
I2(aq) + 6 H2O (l) → 2 IO3–(aq)+ 12 H+ (aq) + 10e–
Son potentiel standard est E°= 1,195 V
En milieu basique (au-delà d’un pH de 9,3) le diode n’est plus stable, il se décompose spontanément (il se dismute) en ions iodates et en ions iodure suivant l’équation de réaction suivante: 3 I2(aq) + 3 H2O (l) → IO3–(aq) + 5 I– + 6 H+ (aq)
Le diiode en tant que principe actif
Le diode dispose de propriétés antiseptiques mises à profit pour désinfecter des plaies ou brûlures superficielles, on le retrouve ainsi dans l’eau iodée ou dans la bétadine.
