Sujet 1 – Partie chimie : Synthèse de la menthone à partir du menthol (Correction)
Parties du programme de physique-chimie première spécialité concerné :
Synthèse organique, Spectroscopie infrarouge, oxydoréduction, avancement, groupes caractéristiques, molécules organiques, masse molaire, extraction par solvant, rendement d’une synthèse.
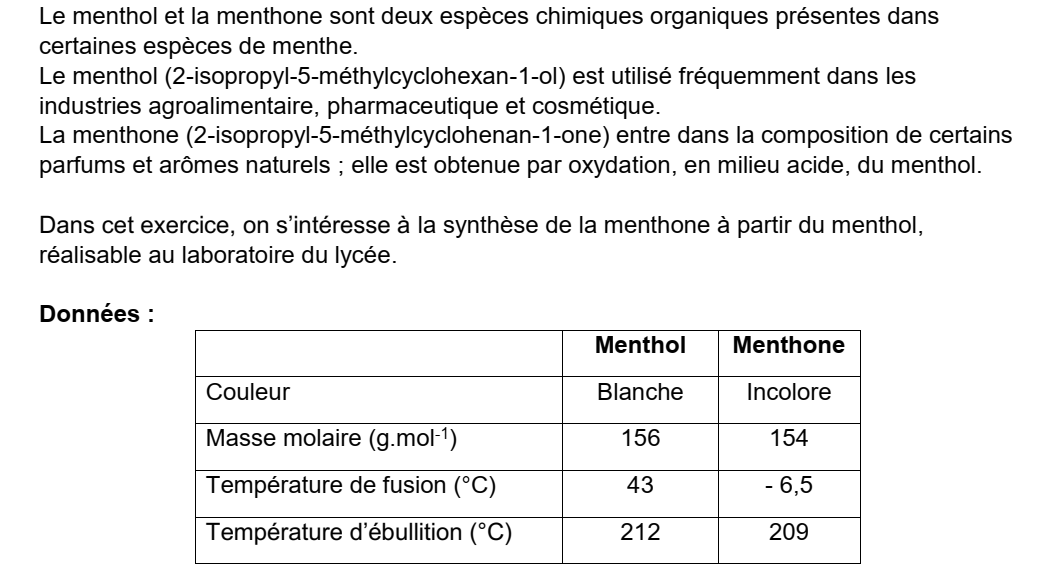
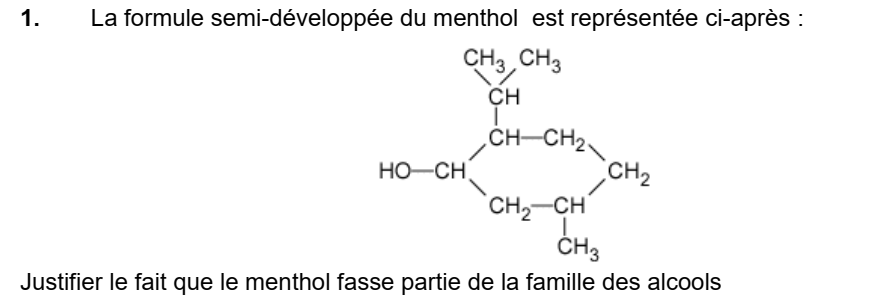
Correction de la question 1)
Le menthol comporte un groupe hydroxyle -OH qui caractérise la famille des alcools.
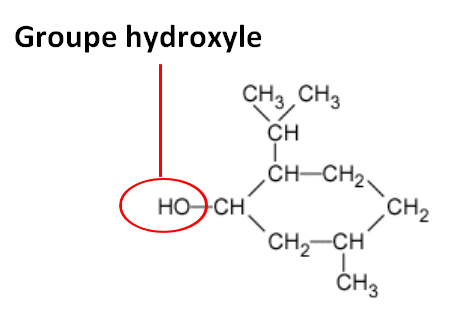

Correction de la question 2
Une cétone comporte un groupe carbonyle C = O par conséquent lorsque le menthol se transforme en menthone le carbone portant le groupe hydroxyle CH – OH est remplacé par un groupe carbonyle . On obtient ainsi la formule semi-développée suivante :
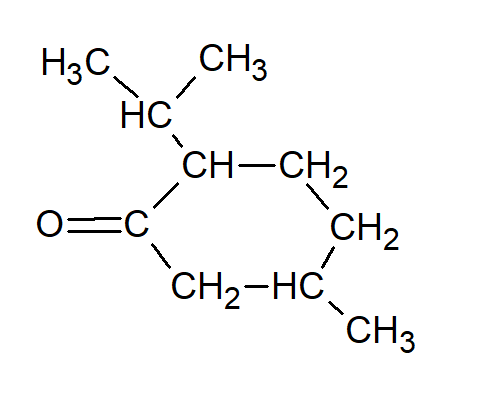
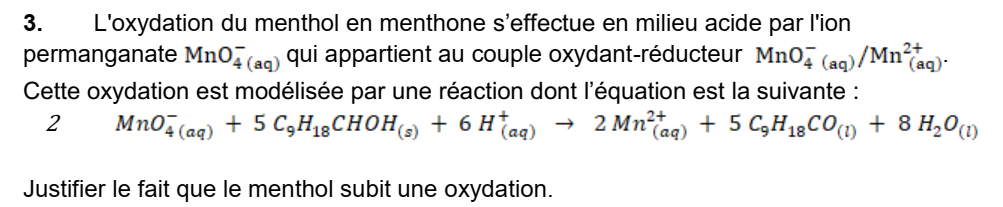
Correction de la question 3
Il existe deux manières de justifier que le menthol subit une oxydation.
Première justification possible :
Le menthol réagit avec l’ion permanganate MnO4– qui est l’oxydant du couple MnO4– / Mn2+ . L’ion permanganate se fait réduire pour former la forme réductrice du couple (Mn2+).
Une réduction (celle de l’ion permanganate) n’est possible que si elle s’accompagne d’une oxydation, par conséquent le menthol subit une oxydation au cours de cette transformation chimique.
Deuxième justification possible :
On peut chercher à écrire la demi-équation du couple formé par le menthol et la menthone afin de vérifier s’il y a bien un échange d’électrons caractéristique d’une oxydation.
Etape 1 – indiquer les deux membres du couples :
C9H18CHOH → C9H18CO
Etape 2 – équilibrer la matière (en tenant compte de la présence des ions hydrogène H+ disponibles dans une solution aqueuse acide) :
C9H18CHOH → C9H18CO + 2H+
Etape 3 – équilibrer la charge électrique en ajoutant les électrons
C9H18CHOH → C9H18CO + 2H+ + 2e–
Cette demi-équation indique que le menthol perd deux électrons lors de sa transformation en menthone :une perte d’électrons correspond bien à une oxydation.
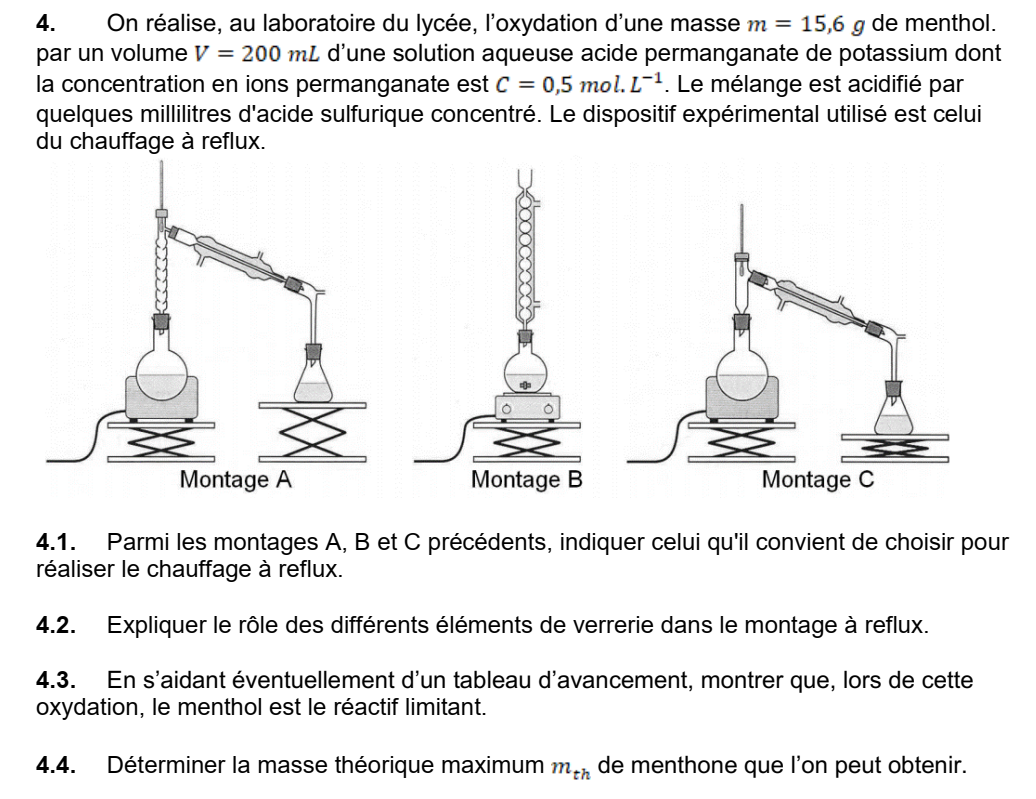
Correction de la question 4.1
Seul le montage B comporte les éléments qui caractérisent un chauffage à reflux : un récipient chauffé surmonté d’un réfrigérant. Le montage A est utilisé lors d’une distillation et le montage C pour une hydrodistillation.
Correction de la question 4.2
Le ballon permet de recevoir le mélange réactionnel qui peut être chauffé de manière homogène par un chauffe-ballon afin d’accélérer la transformation chimique.
Le réfrigérant qui surmonte le ballon permet de liquéfier les vapeurs qui se dégagent du milieu réactionnel en raison du chauffage afin d’éviter de perdre des réactifs ou des produits.
Correction de la question 4.3
Pour réaliser le tableau d’avancement on a besoin, dans un premier temps, de déterminer les quantités de matière initiales des réacfifs.
Quantité de matière initiale de l’ion permanganate :
On dispose de la concentration molaire de la solution et de son volume C = 0,5 mol.L-1 et V = 200 mL soit V = 0,200 L
La quantité de matière se calcule grâce à la relation suivante :
n = C x V
n = 0,5 x 0,200
n = 0,1 moléculaire
La quantité initiale d’ion permanganate est de 0,1 mol
Quantité de matière initiale du menthol :
On dispose de la masse de menthol ( m = 15,6 g ) et de sa masse molaire ( M = 156 g.mol-1)
On peut calculer la quantité de matière à partir de la formule suivante :
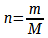
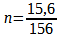
n = 0,1 mol
La quantité de matière initiale du menthol est donc également de 0,1 mol
On peut maintenant établir le tableau d’avancement :
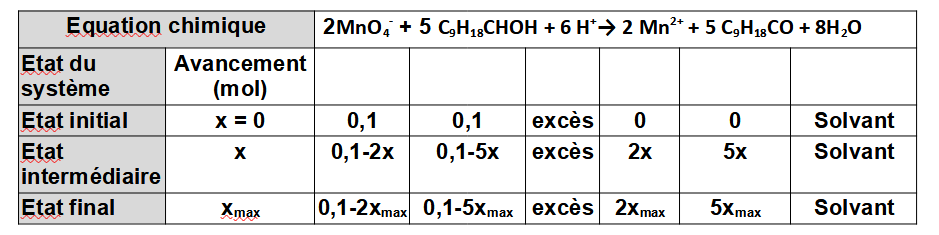
A partir de ce tableau on peut déterminer lequel des réactif joue le rôle de réactif limitant.
Hypothèse n°1 : l’ion permanganate est le réactif limitant.
Sa quantité est nulle à l’état final :
0,1-2xmax = 0
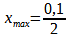
xmax = 0,05 mol
Hypothèse n°2 : le menthol est le réactif limitant.
Sa quantité est nulle à l’état final :
0,1-5xmax = 0
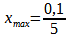
xmax = 0,02 mol
La valeur la plus faible est obtenu dans le cas de l’hypothèse n°2
Par conséquent le réactif limitant est le menthol et l’avancement maximal est xmax = 0,02 mol
Correction de la question 4.4
D’après le tableau d’avancement la quantité de matière de menthone à l’état final est
n = 5 xmax
D’après le résultat de la question précédente (4.3) l’avancement maximal est de 0,02 mol donc :
n = 5 x 0,02
n = 0,1 mol
On peut trouver la masse grâce à la masse molaire et la relation suivante :
m = n x M
D’après les données la masse molaire de la menthone est de 154 g.mol-1
m = 0,1 x 154
m = 15,4 g
La masse maximale théorique de menthone que l’on peut obtenir est donc mth = 15,4 g

Correction de la question 5
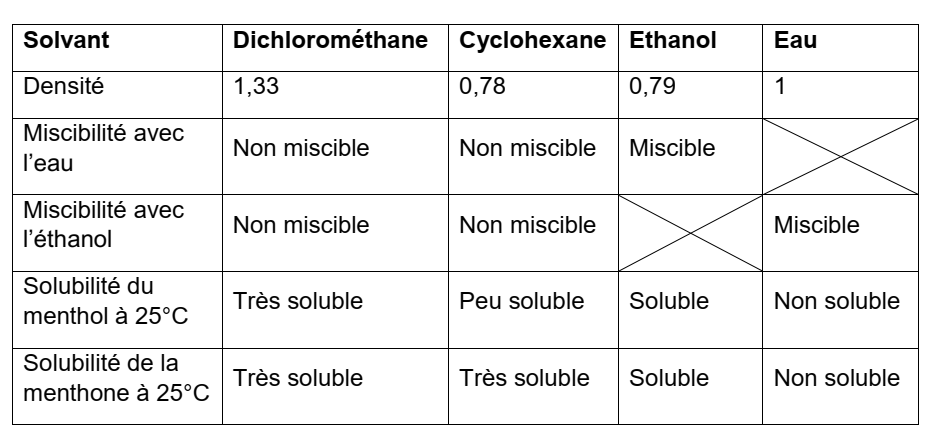
Le solvant à utiliser pour l’extraction doit répondre à deux critères :
- il ne doit pas être miscible avec le solvant du milieu réactionnel (l’eau), ce qui est le cas du cyclohexane et du dichlorométhane mais pas de l’éthanol donc ce dernier est à exclure.
- L’espèce chimique à extraire (la menthone) doit avoir une bonne solubilité dans ce solvant (ce qui valide l’utilisation du cyclohexane et du dichlorométhane).
Pour départager ces deux solvants on doit exploiter une indication de l’énoncé : après décantation la phase organique surnage par conséquent cette dernière doit avoir une densité inférieure à la phase aqueuse (dont la densité est proche 1)
D’après les données seul le cyclohexane a une densité inférieure à 1 (0,78), le dichlorométhane a une densité supérieure à 1 (1,33)
Le solvant à utiliser pour l’extraction est donc le cyclohexane.
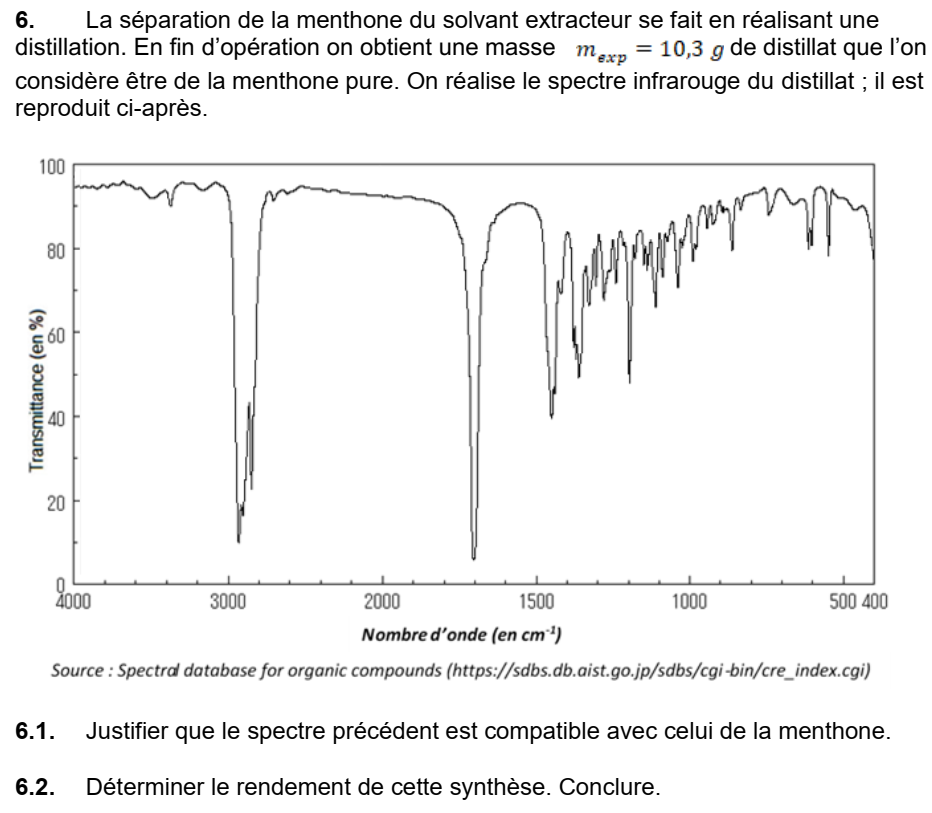
Correction de la question 6.1
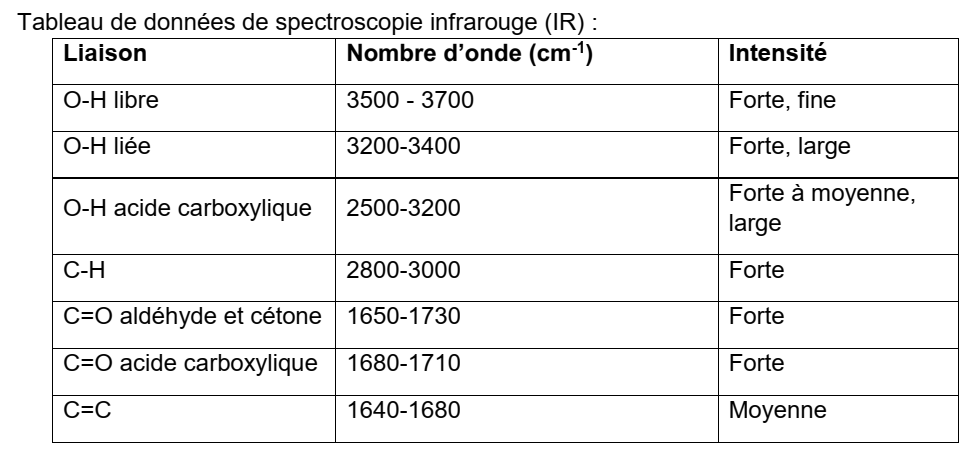
Le spectre IR comporte bien :
- une bande caractéristique du groupe carbonyle C=O d’une cétone vers 1700 cm-1 ( entre 1650 cm-1 et 1730 cm-1)
- une bande caractéristique des liaisons carbone – hydrogène C-H présentes dans une espèce chimique organique entre 2800 – 3000 cm-1)
Par ailleurs il y a bien absence de bandes caractéristiques d’autres groupes ce qui permet d’exclure la présence d’autres fonction chimiques ou de fonctions chimiques incluant un groupe -OH.
Correction de la question 6.2
Le rendement d’une synthèse se note « η » (lettre grecque êta) et peut s’exprimer comme le rapport de la masse de produit synthétisé réellement obtenu (mexp) par la masse de produit maximale que l’on pourrait théoriquement obtenir (mthéo)
Le rendement de la synthèse se calcule donc avec la formule suivante :
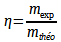
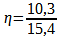
Ce rendement est nettement inférieur à 1, il est possible que la réaction ne soit pas totale où qu’il y ait eu des pertes de matière lors du chauffage malgré le réfrigérant.
