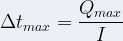Constitution et transformations de la matière – 3. Prévoir l’état final d’un système, siège d’une transformation chimique- A) Prévoir le sens de l’évolution spontanée d’un système chimique.
- Transformation non totale et état d’équilibre
- Taux d’avancement d’une réaction
- Quotient de réaction Qr
- Constante d’équilibre K
- Sens d’évolution spontané d’un système chimique
- Principe de fonctionnement d’une pile électrochimique
- Capacité électrique d’une pile
Transformation non totale et état d’équilibre
Lors de certaines transformations chimiques aucun des réactifs n’est entièrement consommé, par conséquent l’état final du système chimique réunit des produits et les réactifs dont les quantités n’évoluent plus au cours du temps : on dit que de telles transformations chimiques sont non totales.
Une réaction chimique est dite non totale si à l’état final aucun des réactifs n’est total consommé.
Remarque
Lors d’une réaction chimique non totale il n’y a pas de réactif limitant puisqu’aucun réactif n’est totalement consommée.
Une transformation est non totale lorsqu’elle peut se produire dans les deux sens :
si les réactifs « A » et « B » se transforment pour former les produits « C » est « D » au cours d’une réaction non totale alors les espèce chimiques « C » et « D » peut aussi jouer le rôle de réactifs et former, au cours de la transformation inverse les espèces chimiques « A » et « B »
Deux transformations chimiques ont donc lieu simultanément :
- dans le sens direct a A + b B → c C + d D
(a, b, c et d sont les coefficients stoechiométriques respectifs de A, B, C et D)
- et dans le sens indirect c C + d D → aA + b B
Pour indiquer la double transformation qui a lieu lors d’une réaction non totale son équation est notée avec une double flèche (au lieu d’une flèche simple) :
a A + b B ⇆ c C + d D
Lorsqu’une réaction non totale atteint son état final les quantités de matière restent constantes car les espèces chimiques sont consommées et produites à la même vitesse :
L’état final d’une réaction non totale correspond à un équilibre au cours duquel la vitesse de disparition de chaque espèce chimique correspond aussi à sa vitesse de formation.
L’état final d’une réaction non totale est un équilibre dit « dynamique », le système n’est pas figé, les quantités de matière reste globalement constantes mais les deux transformations (dans un sens et son opposé) continuent d’avoir lieu.
Taux d’avancement d’une réaction
Le taux d’avancement est une grandeur définie pour une réaction non totale.
Il se note «τ » (lettre grecque minuscule « tau ») et n’a pas d’unité.
Il est défini comme le rapport de l’avancement de la réaction à l’état final « xf » par l’avancement maximal de la réaction « xmax » :
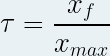
avec xf et xmax en mole (mol) et τ sans unité.
Interprétation de la valeur du taux de réaction :
- Si τ = 0 alors la réaction ne se réalise pas dans le sens considéré ou est totale dans le sens inverse
- Si 0 < τ < 0,5 alors les réactifs restent majoritaires par rapport aux produits à l’état final
- Si τ = 0,5 alors la moitiée des produits a été consommée à l’état final
- Si 0,5 < τ < 1 alors les produits sont majoritaires par rapport aux réactifs à l’état final
- Si τ = 1 alors la réaction est totale.
Quotient de réaction Qr
Si un système chimique (à l’équilibre ou non) est le siège d’une réaction non totale décrite par une équation de la forme suivante :
a A + b B ⇆ c C + d D
Alors le quotient de réaction est la grandeur notée « Qr », sans unité définie à tout moment de la transformation chimique par la relation suivante :
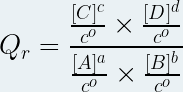
où :
- Qr est le quotient de réaction (pas d’unité)
- [A], [B] sont les concentrations molaires des réactifs en mole par litre (mol.L-1)
- [C], [D] sont les ,concentrations molaires des produits en mole par litre (mol.L-1)
- a, b, c, d sont les coefficients stoechiométriques respectifs des espèces chimiques A, B, C et D
- c° est la concentration molaire standard (c° = 1 mol.L-1)
En tenant compte que la concentration standard a une valeur d’une mole par litre on peut simplifier l’expression du quotient de réaction :
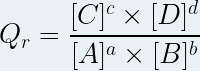
Seules les espèces chimiques dissoutes interviennent dans l’expression du quotient de réaction ( les solides insolubles, le solvant n’interviennent pas).
Constante d’équilibre K
La constante d’équilibre d’une réaction non totale se note « K » et correspond à la valeur prise par le quotient de réaction lorsque l’équilibre est atteint.
Si la constante d’équilibre prend une valeur supérieure à 104 (10000) alors on peut considérer que la réaction est totale dans le sens direct.
Sens d’évolution spontané d’un système chimique
Il est possible de prévoir le sens dans lequel évolue un système chimique en comparant son quotient de réaction à sa constante d’équilibre.
Par définition, si Qr = K alors le système chimique est à l’équilibre (il n’évolue plus, les concentrations restent constantes)
Si Qr < K ( le quotient de réaction est inférieur à la constante d’équilibre) alors le système évolue dans le sens direct (la concentration des réactifs diminue et celle des produits augmente)
Si Qr > K ( le quotient de réaction est supérieur à la constante d’équilibre) alors le système évolue dans le sens non direct (la concentration des réactifs augmente et celle des produits diminue)
Principe de fonctionnement d’une pile électrochimique
Une pile électrochimique correspond toujours à l’association de deux demi-piles :
Une demi-pile associe les deux membres d’un même couple oxydant-réducteur.
Par exemple une demi-pile peut associer du cuivre métallique (Cu) et des ions cuivre (Cu2+) appartenant au couple Cu2+ / Cu.
Ces deux couples ne sont pas mis en contact car sinon il y aurait une réaction directe en entre eux par contre ils sont reliés :
- par un élément assurant la conduction ionique entre les deux demi-piles (souvent un pont salin)
- ainsi que par le circuit électrique externe
Chaque demi-pile est le siège d’une demi-réaction :
- La demi-pile comportant le couple le plus oxydant est le siège d’une réduction (gain d’électrons), elle constitue la cathode.
- La demi-pile comportant le couple le plus réducteur est le siège d’une oxydation (perte d’électrons), elle constitue l’anode.
Les électrons circulent dans le circuit électrique de l’anode vers la cathode.
Pour assurer la neutralité électrique des demi-piles les ions circulent à travers le pont salin :
- Les cations (positifs) migrent vers la cathode (où les électrons négatifs aboutissent)
- Les anion (négatifs) migrent vers l’anode (que les électrons négatifs quittent)
Exemple : la pile cuivre – zinc
Une pile cuivre-zinc est constituée par l’association :
- d’une demi-pile faisant intervenir le couple Cu2+/Cu
- d’une demi-pile faisant intervenir le couple Zn2+/Zn
La demi-pile correspondant au couple Cu2+/Cu peut être obtenue en plongeant une lame de cuivre métallique dans une solution sulfate de cuivre II.
Cu2+ étant plus oxydant que Zn2+ cette demi-pile est le siège de la réduction des ions cuivre suivant la demi équation suivante :
Cu2++ 2e– → Cu
Cette demi-pile constitue la cathode de la pile
La demi-pile correspondant au couple Zn2+/Zn peut être obtenue en plongeant une lame de zinc métallique dans une solution sulfate de zinc.
Cette demi-pile est le siège de l’oxydation du zinc suivant la demi équation suivante :
Zn → Zn2++ 2e–
Cette demi-pile constitue l’anode de la pile
Lorsque cette pile fonctionne les électrons circulent (dans le circuit extérieur à la pile) de l’anode en zinc vers la cathode en cuivre tandis qu’au sein de la pile les cations migrent la cathode en cuivre et les anions vers l’anode en zinc.
Capacité électrique d’une pile
Définition
La capacité électrique d’une pile, notée en général Qmax, correspond à la charge électrique totale (en coulomb) que cette pile est capable de faire circuler dans un circuit électrique externe.
Elle peut être exprimée à partir de la quantité de matière d’électrons que la pile est capable faire circuler à partir de la formule suivante :
Qmax = ne x F
Dans cette formule :
- Qmax est la capacité électrique de la pile en coulomb (C)
- ne est la quantité de matière d’électrons totale que la pile peut faire circuler en mole (mol)
- F est la constante de Faraday qui correspond à la charge électrique d’une mole d’électrons (F = 6,02.1023 x 1,6.10-19 donc F = 9,65.104 C.mol-1 )
La capacité électrique correspond à la charge électrique qu’échangent l’oxydant et le réducteur de la pile jusqu’à ce que l’état d’équilibre (Qr = K) soit atteint.
La capacité électrique est souvent exprimée en une autre unité : l’Ampère-heure (symbole Ah ou A-h)
L’ampère-heure est défini comme la charge électrique échangée lorsqu’un courant électrique d’intensité I = 1 A circule pendant une durée d’une heure.
Il découle de cette définition l’équivalence suivante :
1 Ah = 3600 C
Par conséquent on peut convertir des coulombs en ampère-heure grâce à la relation :
Charge en Ampère-heure = (Charge en Coulomb)/3600
Inversement :
Charge en Coulomb = (Charge en Ampère-heure) x 3600
La durée de fonctionnement d’une pile dépend de sa capacité électrique (et donc de la quantité de réactifs qu’elle contient) mais aussi de l’intensité du courant électrique qu’elle fournit au circuit extérieur.
Etant donné que l’intensité du courant correspond au flux de charge électrique exprimé par la relation :
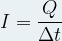
où
- I est l’intensité du courant électrique circulant en Ampère (A)
- Q est la charge électrique en Coulomb (C)
- Δt est la durée pendant laquelle le courant circule en seconde (s)
Alors on peut exprimée la durée de fonctionnement maximale Δtmax d’une pile grâce à la relation suivante :