- Définition
- Notation d’un couple oxydant réducteur
- Demi-équation d’un couple oxydant réducteur
- Réaction entre les espèces chimiques appartenant à deux couples
- Comment savoir si deux espèces chimiques forment un couple oxydant réducteur
Définition
Un couple oxydant réducteur, aussi appelé couple oxydoréducteur ou couple redox est l’association de deux espèces chimiques dont chacune peut être obtenue à partir de l’autre lors d’une réaction impliquant un échange d’électrons.
Chaque couple oxydant réducteur comporte:
- une espèce chimique dite oxydante qui est susceptible de capter des électrons au cours d’une réduction
- une espèce chimique dite réductrice qui est susceptible de céder des électrons au cours d’une réaction d’oxydation
Remarque
L’oxydant est la forme oxydée du couple, il est réduit lors d’une réaction d’oxydoréduction.
Le réducteur est la forme réduite du couple, il est oxydé lors d’une réaction d’oxydoréduction.
Par exemple le cuivre métallique (Cu) et l’ion cuivre (Cu2+) forment un couple car le cuivre ionique en gagnant deux électrons se transforme en atome de cuivre métallique et inversement Cu se transforme en Cu2+ en perdant deux électrons. Dans ce cas:
- Cu2+ est l’oxydant du couple
- Cu est le réducteur du couple
Notation d’un couple oxydant réducteur
Par convention l’oxydant du couple (ox) est toujours noté en premier (à gauche) et le réducteur (red) est noté en deuxième (à droite), la notation d’un couple est donc toujours sous la forme suivante:
Ox/red
Par exemple le couple formé par l’ion cuivre Cu2+ (oxydant) et le cuivre métallique Cu (réducteur) se note:
Cu2+/Cu
La plupart des couples, en particulier les métaux forment des couples de type:
Exemples
- Fe3+/Fe (couple ion ferrique / fer )
- Ag+/Ag (couple ion argent / argent)
- Zn2+/Zn ( couple ion zinc / zinc )
- H+/H2 (couple ion ion hydrogène/dihydrogène)
On trouve aussi des couples de type:
Exemples
Demi-équation d’un couple oxydant-réducteur
La transformation chimique qui permet de passer de l’une des formes d’un couple oxydant-réducteur à l’autre forme peut être modélisée par une demi-équation.
Cette demi-équation traduit l’échange d’électrons qui se fait entre la forme oxydante et la forme réductrice.
Cette équation de réaction est qualifiée de “demi” équation car la transformation qu’elle représente ne peut se réaliser seule, elle doit nécessairement s’accompagner d’une autre transformation impliquant un autre couple oxydant réducteur qui opère aussi un échange d’électrons. Par conséquent une demie équation ne traduit que la moitié d’une réaction d’oxydoréduction.
La demi-équation s’écrit:
- en respectant la règle de conservation des éléments chimiques.
- en respectant la règle de conservation de la charge électrique.
Si la demi équation traduit une oxydation alors:
- la forme réductrice est un réactif, elle est notée à gauche
- la forme oxydante est un produit, elle est notée à droite
- les électrons sont cédés, ils sont notés parmi les produits, à droite.
- les réactifs et produit sont séparés par une flèche simple classique orientée vers la droite
Si la demi-équation traduit une réduction alors:
- la forme réductrice est un produit, elle est notée à droite.
- la forme oxydante est un réactif, elle est notée à gauche
- les électrons sont captés, ils sont notés parmi les réactifs, à gauche.
- les réactifs et produit sont séparés par une flèche simple classique orientée vers la droite.
Si le sens de la transformation n’est pas précisé (on ne sait pas s’il s’agit d’une oxydation ou d’une réduction) alors:
La demie équation s’écrit comme une réduction (oxydant à gauche et réducteur à droite) mais la flèche simple séparant les réactifs est remplacée par une double flèche qui indique que le sens dans lequel les électrons sont échangés reste indéterminé.
Réaction entre les espèces chimiques appartenant à deux couples
Une réaction d’oxydoréduction ne peut se faire qu’entre l’oxydant d’un couple et le réducteur d’un autre couple mais seules certaines combinaisons sont possibles (mais les règles qui permettent de le déterminer ne sont pas au programme de première S).
En résumé une réaction d’oxydoréduction n’est possible qu’entre l’oxydant de certains couples et le réducteur de certains autres couples.
A noter cependant que si une réaction est possible entre l’oxydant d’un premier couple et le réducteur d’un deuxième couple alors elle est impossible entre l’oxydant du deuxième couple et le réducteur du premier couple.
Pour aller plus loin:
Il est possible de déterminer les réactions possibles entre les espèces chimiques de deux couples en comparant le pouvoir oxydant de ces deux couples (qui croit avec une grandeur appelée potentiel standard d’oxydoréduction).
L’oxydant du couple le plus oxydant est capable de d’oxyder le réducteur du couple le moins oxydant
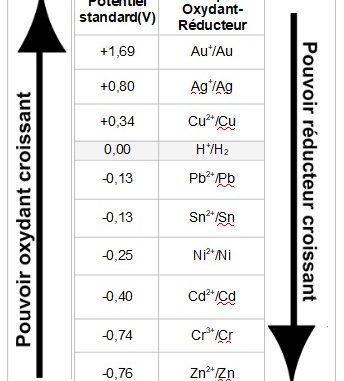
Par exemple le couple H+/H2 a un pouvoir oxydant supérieur à celui du couple Zn2+/Zn par conséquent la réaction d’oxydoréduction possible entre ces deux couple est celle entre les ions hydrogène H+ et le zinc métallique Zn et les produits de cette réaction sont le dihydrogène H2 et les ions zinc Zn2+
Comment savoir si deux espèces chimiques forment un couple oxydant-réducteur ?
Pour savoir si deux espèces chimiques forment un couple oxydant-réducteur il faut vérifier qu’il est possible d’obtenir l’une à partir de l’autre par échange d’électrons (et éventuellement avec intervention des espèces du milieu réactionnel comme l’eau, les ions hydrogène ou les ions hydroxyde).
Il est par conséquent nécessaire que les deux espèces chimiques comportent des éléments chimiques communs. On peut envisager que les espèces chimiques Cu2+ et Cu forment un couple mais il est impossible que Cu2+ et Fe en forment un.
