- Nom
- Formule chimique
- Formule développée
- Schéma de Lewis
- Géométrie
- Catégorie d’ion
- Charge électrique
- Masse molaire
- Conductivité molaire ionique
- Composition
- Formation de l’ion oxonium
- Ions oxonium et acidité
- Détection des ions oxonium en solution aqueuse
- Concentration des ions oxonium en solution aqueuse
- Autres sources d’ions oxonium
- Ressources et documents consacrés à l’ion oxonium
Nom
Son nom est formé:
- du suffixe “onium” que l’on retrouve chez les cations résultant une molécule qui capte un ion hydrogène H+. (par exemple l’ion ammonium NH4+, l’ion phosphonium PH4+ ou encore chez l’ion sulfonium H3S+)
- du préfixe “ox” qui désigne l’ “oxygène”, l’élément central de cet ion.
Ce nom est celui préconisé par IUPAC (l’union internationale de chimie pure et appliquée) cependant il est souvent appelé ion hydronium et parfois aussi ion hydroxonium.
Remarque
En chimie le terme “oxonium” peut être utilisé dans un sens plus large qui désigne une espèce chimique où un oxygène porte une charge positive (il forme un cation) et établit trois liaisons covalentes.
Formule chimique
Sa formule brute est:
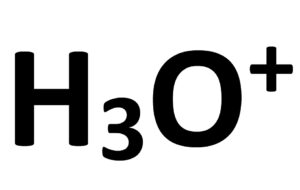
Formule développée:
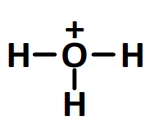
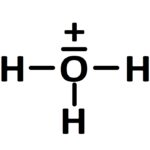
Schéma de Lewis:
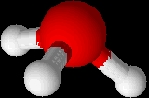
Géométrie
L’oxygène (élément central de cette ion) établit trois liaisons covalentes avec des hydrogène et porte un doublet non liant.
Sa figure de répulsion est de type AX3E1
L’ion oxonium possède donc une géométrie pyramidale à base triangle dont l’oxygène occupe le sommet et les hydrogène la base.
Catégorie d’ion
C’est un cation, un ion positif
Charge électrique
Il porte une seule charge élémentaire positive par conséquent, sa charge totale est
q = +e
q = +1,6.10-19 C
Masse molaire
L’ion oxonium, de formule H3O+, est composé d’un oxygène et de trois hydrogènes donc:
M(H3O+) = M(O) + 3 x M(H)
M(H3O+) = 16,0 + 3 x 1,0
M(H3O+) =19,0 g.mol-1
La masse molaire de l’ion oxonium est donc de 19 grammes par mol
M(H3O+) =19,0 g.mol-1
Conductivité molaire ionique
L’ion oxonium possède l’un des conductivités molaires ioniques les plus élevées:
λ(H3O+) = 34,98 mS.m2.mol-1
Composition
L’ion oxonium est constitué d’un oxygène central lié à trois hydrogènes.
Formation de l’ion oxonium
Formation de l’ion oxonium par réaction entre un acide et l’eau
Il se forme par réaction chimique entre une molécule d’eau et une espèce chimique acide. Lors de cette transformation acide-base, l’espèce chimique acide transfert un ion hydrogène à la molécule d’eau qui forme un ion oxonium tandis que l’espèce acide forme sa base conjuguée.
Voir cours de terminale spécialité sur les transformations acide-base:
Si l’espèce chimique est de type AH alors l’équation de réaction a la forme suivante:
H2O + AH → H3O+ + A–
Exemple
La réaction entre l’eau et l’acide nitrique forme l’ion oxonium et l’ion nitrate
H2O + HNO3 → H3O+ + NO3–
Formation de l’ion oxonium par autoprotolyse de l’eau
Les ions oxoniums sont naturellement présents dans l’eau, y compris dans une eau dite “pure”. Ils se forment par réaction entre les molécules d’eau (réaction dite d’autoprotolyse de l’eau).
En effet, l’eau est amphotère, elle peut jouer le rôle d’un acide ou d’une base, une molécule d’eau “acide” peut réagir avec une molécule d’eau basique pour former un ion oxonium et un ion hydroxyde selon l’équilibre suivant:
H2O + H2O ⇆ H3O+ + OH–
Ions oxonium et acidité
L’acidité d’une solution dépend de sa concentration en ions oxonium:
- Une solution est neutre si [H3O+]= 10-7 mol.L-1 (ce qui équivaut à pH =7) Les seuls ions présents dans cette solution sont ceux qui proviennent de l’autoprotolyse de l’eau.
- Une solution est acide si [H3O+] > 10-7 mol.L-1 (ce qui équivaut à pH < 7)
- Une solution est basique si [H3O+] < 10-7 mol.L-1 (ce qui équivaut à pH > 7)
Détection des ions oxonium en solution aqueuse
Pour détecter la présence d’ions oxonium dans une solution aqueuse (non issus de l’autoprotolyse de l’eau) il suffit de mesurer le pH (pH-mètre, papier pH) et de vérifier que ce dernier est bien inférieur à 7.
Concentration des ions oxonium en solution aqueuse
Le pH d’une solution peut être exprimée en fonction de la concentration en ion oxonium:
pH = – Log ([H3O+])
Il est également possible d’exprimer la concentration des ions oxonium à partir du pH:
[H3O+] = 10-pH
Autres sources d’ions oxonium
La forme la plus courante d’ions oxonium (celles évoquée dans ce cours) est celle dissoute en solution aqueuse mais l’ion oxonium peut se présenter sous d’autres formes:
Il peut former des solides ioniques, comme par exemple le perchlorate d’oxonium (où ils sont associés à des ions perchlorate ClO4–
Ressources et documents consacrés à l’ion oxonium
Fiche IUPAC ion oxonium – https://goldbook.iupac.org/terms/view/O04378
Cours de première spécialité “pH et concentration en ions oxonium“