- Qu’est ce qu’une formule développée ?
- Les avantages et inconvénients de la formule développée
- Qu’est ce qu’une liaison ?
- Symboles des liaisons
- Nombres de liaisons des principaux éléments chimiques
- Écrire une formule développée
- Formule développée d’une molécule organique
- Trouver une formule brute à partir d’une formule développée
Qu’est ce qu’une formule développée ?
Définition
Une formule développée est la représentation d’une molécule qui fait figurer les liaisons entre atomes.
Les avantages et inconvénients de la formule développée
Elle apporte davantage d’informations que la formule brute:
- elle indique aussi la composition de la molécule
- elle permet de visualiser l’enchaînement des atomes.
- donne une idée élémentaire de la géométrie de la molécule.
- permet de faire apparaître des groupes particuliers d’atomes (groupes caractéristiques) qui ont une influence sur la réactivité de la molécule.
- permet de distinguer des molécules ayant la même composition (donc la même formule brute) mais dont l’enchaînement des atomes est différent (de telles molécules sont dites isomères)
Inconvénients:
- Le principal inconvénient de la formule développée est la place importante que peut nécessiter son écriture (en particulier pour les “grosses” molécules organiques), dans ce il peut être préférable de choisir la formule semi-développée)
Qu’est ce qu’une liaison ?
Dans une molécule ont dit que deux atomes sont liés lorsqu’il existe entre eux une interaction qui les maintient ensemble
Cette interaction se fait entre les deux noyaux atomiques et une partie des électrons de chacun d’entre eux. Elle correspond pour chaque atome à un état plus stable que s’ils étaient isolés par conséquent ils ne peuvent quitter cet état (et donc rompre la liaison) que si une énergie suffisante leur est fournie (par exemple sous forme de rayonnement lumineux ou lors d’une transformation chimique).
On peut comparer la stabilité acquise par un atome grâce à une liaison à celle obtenue lorsqu’il gagne des électrons pour compléter sa couche externe (règles du duet et l’octet)
En effet (cette notion sera étudiée en première S), la formation d’une liaison peut être interprétée comme la mise en commun d’un électron par chacun des atomes liés, par conséquent on peut considérer que chaque atome bénéficie d’un électron supplémentaires.
Les éléments chimiques susceptibles de former une ou des liaisons sont donc ceux qui ont besoin de gagner des électrons pour compléter leur couche externe, ils sont principalement situés dans les colonnes de droite du tableau périodique (à l’exception de la toute dernière qui comporte les gaz nobles).
Symboles des liaisons
On distingue plusieurs types de liaisons:
Les liaisons simples correspondent à l’établissement d’une seule liaison entre deux atomes, elles sont symbolisées par un trait (horizontal ou vertical) joignant les deux atomes liés:
![]()
Exemple
La liaison simple entre les deux atomes d’hydrogène de la molécule de dihydrogène:
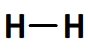
Les doubles liaisons (ou liaisons doubles) correspondent à l’établissement de deux liaisons entre deux atomes identique. Elles sont symbolisées par un double trait (deux traits parallèles) verticaux ou horizontaux joignant les deux atomes liés.
![]()
Exemple
La double liaison entre les deux atomes d’oxygène d’une molécule de dioxygène
Les triples liaisons (ou liaisons triples) correspondent à l’établissement simultané de trois liaisons entre deux mêmes atomes. Une telle liaison est représentée par un triple trait (trois traits parallèles) verticaux ou horizontaux qui joignent les atomes liés.
![]()
Exemple
La triple liaisons entre les deux atomes d’azote d’une molécule de diazote.
![]()
Nombres de liaisons des principaux éléments chimiques
Chaque élément chimique ne forme qu’un nombre précis de liaisons. Pour être correcte une formule développée doit respecter ce nombre il est donc nécessaire de connaître le nombre de liaisons correspondant aux éléments les plus courants.
- Hydrogène: 1
- Carbone: 4
- Oxygène: 2
- Azote: 3
- Chlore:1
D’une manière générale tous les éléments de l’avant dernière colonne forment une seule liaison.
Remarques
L’hydrogène et le chlore forment nécessairement une seule liaison simple.
L’oxygène forme:
- soit deux liaisons simples
- soit une seule double liaison
L’azote forme:
- soit trois liaisons simples
- soit une triple liaison
- soit une liaison simple et une double liaison
Le carbone forme:
- soit quatre liaisons simples
- soit une liaison simple et une triple liaison
- soit deux liaisons simples et une double liaison
Écrire une formule développée
La formule développée est écrite en suivant les règles suivantes:
- tous les atomes sont individuellement représentés par leur symbole (si par exemple la molécule comporte 3 carbone alors le symbole C y figure 3 fois.
- les liaisons sont représentées par leur symbole
- chaque élément chimique doit comporter le nombre de liaisons qui lui est propre (1 pour l’hydrogène, 4 pour le carbone etc)
Ensuite, par tâtonnements, on tente de disposer les atomes de manière à obtenir une formule qui respecte ces règles de base. Il peut arriver que différentes formules développées soient possibles dans ce cas on parle de molécules isomères. Il est parfois nécessaire de disposer d’informations supplémentaires ( présence de certains enchaînements, de groupes caractéristiques, de liaisons multiples etc) pour pouvoir conclure.
Exemple de l’eau
Sa formule est H2O, elle est constituée d’un oxygène formant deux liaison et de deux hydrogène formant chacun une liaison. Chaque hydrogène est donc lié à l’oxygène.
Exemple du dioxyde de carbone
Sa formule est CO2, il est constitué d’un carbone qui forme 4 liaisons et de deux oxygène formant chacun deux liaison. La seule possibilité est que le carbone forme une double liaison avec chacun des atome d’oxygène
Formule développée d’une molécule organique
Les espèces chimiques organiques sont toujours constituées de carbone et d’hydrogène, parfois d’oxygène et d’azote, éventuellement d’autres éléments. Les atomes de carbone forment ce qu’on appelle le squelette de la molécule auquel se rattachent les autres atomes et parfois des groupements carbonées. Pour établir la formule développée d’une molécule organique, il est préférable de commencer par noter les carbones et chercher leur enchaînement tandis que les hydrogène ne sont ajoutés qu’à la fin.
Exemple du propane
Sa formule est C3H8, les 3 carbone sont liés en ensemble pour former les le squelette de la molécule et les hydrogène se lie avec les carbone pour toutes les liaisons restantes
Trouver une formule brute à partir d’une formule développée
Si la formule développée d’une espèce chimique est connue il est facile d’en déduire sa formule brute, il suffit de:
- repérer les différents symboles atomiques qui figureront aussi dans la formule brute
- de compter le nombre d’atomes correspondant à chaque éléments puis de noter chacun de ces nombre en indice de chaque symbole.
