- Définition
- Distinguer des isomères à partir de leurs formules
- Différences et points communs entres isomères
- Trouver les isomères ayant la même formule brute
- Exemples de recherche d’isomères
Définition
Deux espèces chimiques sont dites isomères si leurs molécules ont la même composition (les mêmes éléments chimiques en même nombre) mais que leurs atomes sont liés de manière différentes.
Il y a donc isomérie si deux molécules ont exactement des mêmes atomes mais qu’ils s’enchaînent de manière différente.
Remarque
Une seule liaison différente suffit pour que deux molécule soient considérées comme isomères.
Distinguer des isomères à partir de leurs formules
Par définition la formule brute ne traduit que la composition d’une molécule tandis les formules développées indiquent aussi les liaisons entre atomes par conséquent:
Deux espèces chimiques sont isomères si elles ont la même formule brute mais que leur formule développée (ou semi-développée) sont différentes.
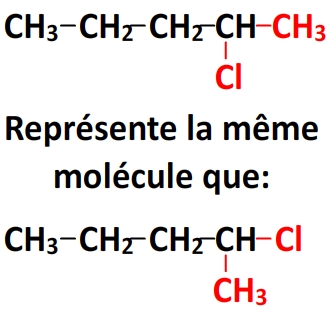
Exemple
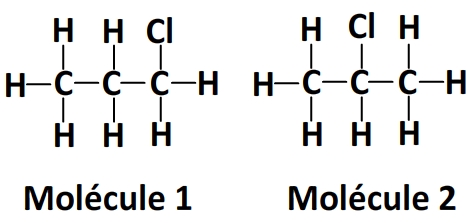
Les deux espèces chimiques ci-dessus ont la même formule chimique (C3H7Cl) mais leur formule développée est différente. Dans la molécule 1 l’atome de chlore est lié à un carbone en bout de chaîne tandis que dans la molécule 2 il est lié au carbone central donc il s’agit bien d’isomères.
Différences et points communs entres isomères
Des isomères correspondent à des espèces chimiques différentes par conséquent leurs seuls points communs sont:
- leur composition atomique
- leur formule brute
- leur masse molaire moléculaire
Toutes leurs autres propriétés physiques et chimiques sont différentes
Ils différent par:
- leur masse volumique et leur densité
- leur température de fusion ou d’ébullition
- leur réactivité chimique
- Etc
Trouver les isomères ayant la même formule brute
Pour trouver les isomères correspondant à une même formule brute il suffit de faire la listes de toutes les formules développées (ou semi-développées) possibles.
Pour les “petites” molécules il est possible de procéder par tâtonnements en cherchant les différentes combinaisons d’atomes respectant le nombre de liaisons de chaque élément mais pour les molécules plus longues et en particulier pour les molécules organique il est nécessaire d’ être méthodique.
Pour rappel les molécules organiques sont constituées d’un enchaînement, linéaire ou non, de carbone auxquels sont liés des hydrogène et parfois d’autres éléments (en général de l’oxygène, de l’azote, du chlore ou du soufre)
La méthodes permettant de lister les isomères d’une molécule organique peut être la suivante.
Etape 1: Vérifier la présence de liaisons multiples
il suffit de faire un “test” en écrivant la formule développée correspondant à un isomère dans lequel:
- tous les éléments établissant au moins deux liaisons (carbone, oxygène, azote) forment une chaine (sont liés les uns à la suite des autres)
- tous les éléments établissant une seule liaison (hydrogène, chlore..) sont liés aux atomes de la chaîne précédente
On vérifie ensuite que tout les éléments de la chaîne forment bien un nombre de liaisons correct (4 pour le carbone, 2 pour l’oxygène etc) et qu’il ne manque pas de liaisons à certains:
- Si tous les éléments de la chaîne forment un nombre correct de liaisons alors les isomères de cette formule brute n’ont pas de liaisons multiples
- Si deux liaisons n’ont pas été établies alors les isomères ont tous une double liaison.
- Si quatre liaisons n’ont pas été établies alors les isomères ont soit une triple liaison, soit deux doubles liaisons
- etc
Etape 2: Lister les chaînes d’atomes possibles
Il faut faire la liste de tous les enchaînements possibles à base des atomes formant au moins deux liaisons, à savoir principalement le carbone, l’azote et l’oxygène (cet enchaînement, surtout constitué de carbone est appelé squelette carboné).
- ils peuvent s’associer de manière totalement linéaire
- si la molécule a plus de 3 carbones il faut envisager de possibles ramifications, c’est-à-dire des groupes d’un ou plusieurs carbones liés à la chaîne principales linéaire.
- il est parfois possible d’avoir des ramifications de tailles différentes, reliées à différents carbone de la chaîne principale dont la longueur varie en fonction de ces derniers.
- les ramifications peuvent elles-mêmes être ramifiées.
- dans le cas de liaisons multiples ces dernières peuvent occuper différentes positions dans la chaîne principale de carbone ou dans les ramifications.
Étape 3: inclure les atomes formant une seule liaison (à l’exception de l’hydrogène)
- Ils peuvent être liés au différents atomes des chaînes obtenues à la fin de l’étapes 2, chacune de leur position correspond à un isomère
- Dans le cas ou plusieurs de ces atomes sont présent alors il faut rechercher les différentes combinaisons de position possible
Étape 4: ajouter les hydrogènes
Il suffit de compléter les différentes combinaisons obtenues à l’étape précédente s’il n’y a pas d’erreur alors les hydrogènes viennent compléter naturellement les liaisons encore vacantes des atomes de la chaîne.
Les formules développées ainsi obtenues sont celles d’isomères ayant la même formule brute mais il faut cependant veiller à ne pas considérer comme isomère des molécules identiques dont les formules développée semblent de prime abord différentes mais qui sont en réalité équivalente.
Étape 5: vérifier l’absence de doublons dans la liste.
Ces doublons correspondent à des formules notées de manière légèrement différentes mais qui sont en réalité équivalente.
Par exemple pour une molécule comportant une chaîne linéaire de 5 carbones, 11 hydrogènes et un chlore, il est équivalent:
– de noter le chlore en haut ou en bas du deuxième carbone de la chaîne:
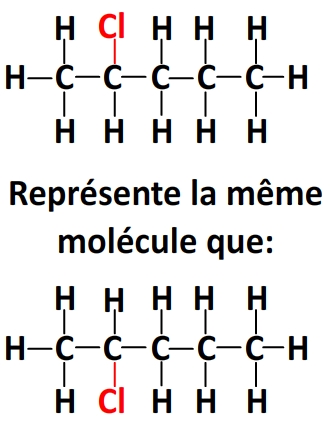
– de lier le chlore au premier carbone ou au dernier
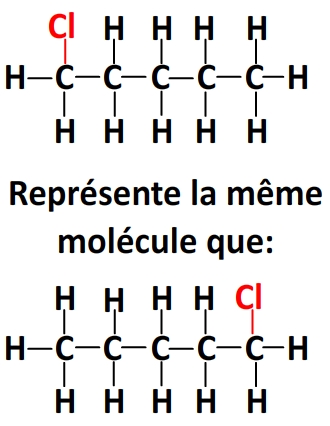
– de lier le chlore au deuxième carbone de la chaîne ou à l’avant-dernier.
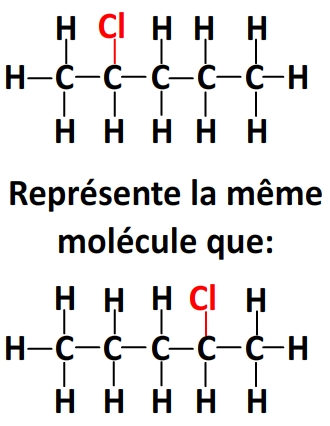
– de noter le dernier groupe CH3 à droite, en haut ou en bas de l’avant-dernier carbone.
Exemples de recherche d’isomères
Isomères ayant pour formule C2H6O
- Le “test” des liaisons multiples montre qu’elles sont absente des isomère
- Les deux carbones et l’oxygène ne permette d’obtenir que les deux chaînes suivantes:

- Par conséquent il y a deux formules semi-développée possibles donc deux isomères de formules développées:

Isomères ayant pour formule C2H4O
- Le test des liaisons multiples montre que les isomères comportent une double liaison
- Recherche des chaines possibles:

- Il en résulte au final deux isomères dont les formules développées sont les suivantes:
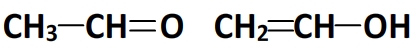
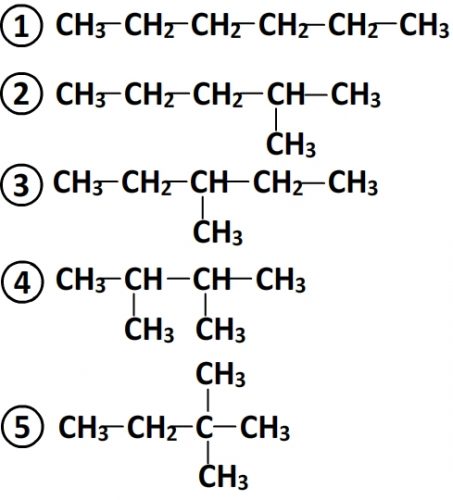
Isomères ayant pour formule C6H14
- Les isomères ne possèdent pas de liaisons multiples
- On dénombre 5 chaînes possibles:
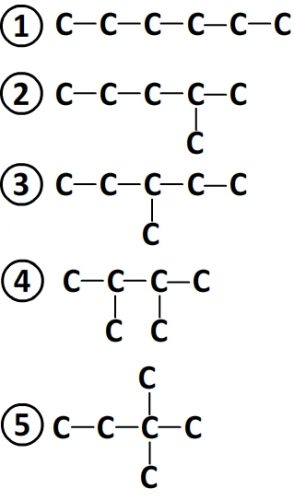
- Ces 5 chaînes coïncident avec 5 formules développées possible d’où un total de 5 isomères