Le cours de chimie “Vers des entités plus stables chimiquement” fait partie du programme de seconde: Constitution et transformations de la matière – Partie 1: de l’échelle macroscopique à l’échelle microscopique – B) Modélisation de la matière à l’échelle microscopique
Les gaz nobles
Les gaz nobles sont éléments chimiques regroupés dans la dernière colonne du tableau périodique. Cette famille regroupe:
- L’hélium (He), Z = 2
- Le néon (Ne) Z = 10
- L’argon (Ar) Z = 18
- Le krypton (Kr) Z = 36
- Le radon (Rn) Z = 54
Ce sont les éléments chimiques les plus stables du tableau périodique, ils n’existent que sous forme d’atome et ne participent quasiment à aucune réaction chimique.
Leur exceptionnelle stabilité chimique s’explique par une couche de valence saturée (entièrement remplie d’électrons)
Par exemple:
- la configuration électronique de l’hélium est 1s2 , sa couche de valence (couche n°1) est saturée par deux électrons
- la configuration électronique du néon est 1s22s22p6, sa couche de valence (couche n°2) est saturée par 8 électrons
- la configuration électronique de l’argon est 1s22s22p63s23p6, sa couche de valence (couche n°3) est saturée par 8 électrons.
Voir cours “La famille des gaz nobles”
Les règles de stabilité chimique
Une entité monoatomique est stable si sa configuration électronique est identique à celle du gaz noble le plus proche dans le tableau périodique.
Dans le cas des éléments chimiques des trois premières périodes du tableau périodique, ils se trouvent sous une forme stable à condition:
- que la couche de valence soit saturée par deux électrons (pour ceux dont le gaz noble le plus proche est l’hélium)
- que la couche de valence soit saturée par huit électrons (pour ceux dont le gaz noble le plus proche est le néon ou l’argon)
Voir cours “Règles de stabilité chimique”
Les ions monoatomiques
Un ion monoatomique est une entité chimique formée d’un seul noyau atomique, elle est électriquement chargée en raison d’un excès ou d’un défaut d’électrons par rapport au nombre de protons.
Les ions monoatomiques stables respectent les règles de stabilité:
- Les atomes ayant une couche de valence presque pleine la sature en gagnant des électrons et forment des anions.
- Les atomes ayant une couche de valence avec peu d’électrons vont les perdre et forment des cations.
Par exemple:
- L’atome de fluor (Z = 9) a pour configuration électronique 1s22s22p5 , il manque seulement un électron pour saturer la couche électronique n°2 par conséquent il forme un ion stable en gagnant un électron. L’ion stable du fluor (l’ion fluorure) possède donc un excès d’un électron, il a pour formule chimique F–.
- L’atome de magnésium (Z=12) a pour configuration électronique 1s22s22p63s2 , il a deux électrons de la couche n°3 à perdre pour faire de la couche n°2 une couche de valence saturée. L’ion stable du magnésium possède donc un défaut de deux électrons et il a pour formule chimique Mg2+.
En classe de seconde il est demandé de connaître les ions monoatomiques suivants:
- l’ion hydrogène de formule H+
- l’ion sodium de formule Na+
- l’ion potassium de formule K+
- l’ion calcium de formule Ca2+
- l’ion magnésium de formule Mg2+
- l’ion fluorure de formule F–
- l’ion chlorure de formule Cl–
Voir cours “Les
ions monoatomiques”
Doublets liants, liaisons de covalence
Les atomes d’une molécule respectent les règles de stabilité en formant des liaisons de covalence.
Lorsque deux atomes se lient entre eux, c’est à dire lorsqu’ils forment une liaison de covalence, ils mettent chacun en commun l’un de leurs électrons de valence:
- chaque atome permet à son partenaire de “bénéficier” d’un électron supplémentaire qui appartient simultanément au deux atomes liés.
- Chaque liaison de covalence formée par un atome lui permet donc d’obtenir un électron supplémentaire (partagé avec son partenaire) dans sa configuration électronique.
Les deux électrons mis en commun lors de la formation d’une liaison de covalence entre deux atomes forment ce que l’on appelle un doublet liant.
Pour respecter les règles de stabilité un atome forme donc autant de liaisons covalentes qu’il manque d’électrons pour saturer sa couche de valence.
Exemples:
- Il manque 4 électrons à l’atome de carbone pour saturer sa couche de valence donc il forme toujours 4 liaisons de covalence.
- Il manque un électron à l’atome d’hydrogène pour saturer sa couche de valence par conséquent il forme toujours une seule liaison de covalence.
On retient pour les atomes courants:
- Hydrogène (H): une seule liaison de covalence
- Carbone (C): 4 liaisons
- Azote (N): 3 liaisons
- Oxygène (O): 2 liaisons
- Halogènes (F, Cl, Br et I): une liaison
- Gaz nobles: aucune liaison.
Voir cours “Les doublets liants”
Les doublets non liants
Lorsqu’un atome fait partie d’une molécule certains de ses électrons de valence sont mis en commun avec les atomes auxquels il est lié mais les autres électrons de valence se regroupent aussi par paires et forment des doublets non liants.
Un doublet non liant est une paire d’électrons de valence formé par les électrons de valence non engagés dans un doublet non liant.
Pour trouver le nombre de doublets non liant il faut:
- trouver le nombre d’électrons de valence
- déterminer combien de ces électrons forment des doublets liants
- calculer le nombre d’électrons de valence restant
- diviser ce nombre par deux pour trouver le nombre de doublets non liants
Par exemple:
l’oxygène (Z=8) a pour configuration électronique 1s22s22p4, il a 6 électrons externes (2 sur 2s et 4 sur 2p) et forme 2 liaisons covalentes (pour saturer sa couche externe). Ces deux liaisons covalentes se forment par la mise en commun de deux électrons externes.
Par conséquent parmi les 6 électrons externes de l’oxygène deux forment des doublets liants et il en reste 4 qui se regroupent par paires pour former 2 doublets non liants.
Chaque atome possède toujours le même nombre de doublets non liants, on peut retenir pour les atomes courants:
- Hydrogène (H): aucun doublet non liant
- Carbone (C): aucun doublet non liant
- Azote (N): 1 doublet non liant
- Oxygène (O): 2 doublets non liants
- Halogènes (F, Cl, Br et I): 3 doublets non liants
Voir cours “Les doublets non liants”
Schéma de Lewis
Le schéma de Lewis (aussi appelés représentation ou formule de Lewis) est la représentation d’une molécule comportant tous les doublets liants ou non liants.
Pour établir un schéma de Lewis il suffit de tenir compte du nombre de liaisons et de doublets non liants associés à chaque atome.
Exemple: Formule de Lewis de l’eau
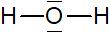
Voir cours “Schéma de Lewis”
Energie de liaison
L’énergie de liaison correspond à l’énergie nécessaire pour rompre une liaison covalente c’est à dire pour séparer deux atomes liés entre eux.
Voir cours “Notion d’énergie de liaison”
Les autres cours de physique-chimie niveau seconde
- Corps purs et mélanges au quotidien
- Les solutions aqueuses, un exemple de mélange
- Du macroscopique au microscopique, de l’espèce chimique à l’entité
- Le noyau de l’atome, siège de sa masse et de son identité
- Le cortège électronique de l’atome définit ses propriétés chimiques
- Vers des entités plus stables chimiquement
- Transformation physique
- Transformation chimique
- Transformation nucléaire
- Décrire un mouvement
- Modéliser une action sur un système
- Principe d’inertie
- Emission et perception d’un son
- Vision et image
- Circuits électriques
- Capteurs
