Ce cours correspond à la partie ” Suivi et modélisation de l’évolution d’un système chimique ” du programme de physique-chimie de première spécialité.
Il est situé dans la partie du programme “Constitution et transformations de la matière – Suivi de l’évolution d’un système, siège d’une transformation”
- Qu’est-ce qu’une oxydation ?
- Qu’est-ce qu’une réduction ?
- Oxydants
- Réducteurs
- Les couples oxydant-réducteur
- Exemple du couple oxydant-réducteur Ag+/Ag
- Qu’est-ce qu’une oxydoréduction ?
- Equilibrage direct d’une équation d’oxydoréduction
- Exemple d’équilibrage direct: réaction des ions argent avec le cuivre métallique
- Méthode recommandée pour équilibrer une réaction d’oxydoréduction
- Les coefficients stoechiométriques
- Conditions stoechiométriques d’une transformation chimique
- Réactif limitant
- L’avancement de la réaction
- Utiliser l’avancement pour exprimer une quantité de matière
- Tableau d’avancement
- Trouver le réactif limitant et l’avancement maximal
A réviser – Les autres cours de première spécialité – Pour approfondir et découvrir
Les réactions d’oxydoréduction
1. Qu’est-ce qu’une oxydation ?
Définition
Il y a oxydation d’une espèce chimique lorsque celle-ci perd un ou plusieurs électrons.
Espèce chimique oxydée
Vocabulaire: lorsqu’une espèce chimique subit une oxydation on dit qu’elle se fait oxyder et elle se transforme en une espèce chimique oxydée.
Comment reconnaitre une oxydation?
Par définition il s’agit d’une transformation chimique où l’on peut remarquer qu’une espèce perd un ou plusieurs électrons.
En pratique il faut vérifier qu’un des produits a une charge globale augmentée par rapport à l’un des réactifs.
En effet, une perte d’électron équivaut à une perte de charge négative et à une augmentation de la charge globale. S’il y a une oxydation on pourra ainsi observer l’un des changements suivant:
- une espèce chimique neutre forme un cation (par exemple Fe forme Fe2+ ou Fe3+)
- une espèce chimique négative devient neutre (par exemple deux ions Cl– forme du dichlore Cl2)
- la charge d’un cation augmente (par exemple l’ion fer II Fe2+ forme l’ion fer III Fe3+)
Oxydation et réduction
Les électrons perdus lors d’une oxydation sont nécessairement captés par une autre espèce chimique qui subit alors une réduction.
Une oxydation est indissociable d’une réduction, lorsqu’une espèce chimique subit une oxydation alors une autre subit forcément une réduction.
Décrire une une oxdation par une demi-équation d’oxydation
Une oxydation peut être représentée par une demi-équation d’oxydation.
Cette demi-équation traduit la transformation chimique subie par l’espèce chimique qui subit l’oxydation.
Elle suit toutes les règles habituelles d’écriture d’une équation de réaction:
- formules chimiques des réactifs notées à gauche et séparées d’un signe “+”.
- formules chimiques des produits notées à droite et aussi séparées d’un signe “+”.
- une flèche orientée vers la droite sépare les formules des réactifs et des produits en indiquant le sens de la transformation.
- des coefficients stoechiométriques sont ajoutés, lorsque c’est nécessaire, pour traduire la conservation des éléments chimiques et de la charge électrique.
Il y a cependant une différence notable avec les équations de réactions classiques: on y fait figurer les électrons perdus lors de l’oxydation:
Exemple
La demi-équation d’oxydation du fer “Fe” en ions fer “Fe2+” est :
Fe → Fe2+ + 2e–
Cette demi-équation montre que lors de l’oxydation d’un atome de fer en ion fer II deux électrons sont cédés.
Dans cet exemple:
- Le fer Fe subit une oxydation (il se fait oxyder)
- L’espèce chimique oxydée qui se forme est l’ion fer II Fe2+.
Voir aussi cours “L’oxydation”
2. Qu’est-ce qu’une réduction ?
Définition
Une espèce chimique subit une réduction si, lors d’une transformation chimique, elle “capte” (gagne) un où plusieurs électrons.
Remarque
Une réduction correspond au phénomène inverse de l’oxydation.
Espèce chimique réduite
Vocabulaire: l’espèce chimique subissant une réduction se fait réduire et il en résulte une nouvelle espèce chimique dite réduite.
Comment reconnaitre une réduction ?
Il est possible d’identifier une réaction de réduction en repérant une espèce chimique se formant grâce à un gain d’électron(s). Dans ce cas la charge électrique apparente de cette espèce chimique semble diminuer puisqu’un gain d’électrons correspond à un gain de charge négative.
Il peut s’agir:
- d’une espèce chimique neutre formant un anion (par exemple le soufre “S” forme un ion sulfure “S2-“)
- d’une espèce chimique positive formant une espèce chimique neutre (par exemple le cation zinc Zn2+ forme du zinc Zn)
- d’une espèce chimique dont la charge positive diminue (par exemple Fe3+ forme Fe2+)
Réduction et oxydation
Si une espèce chimique gagne des électrons alors ces derniers proviennent nécessairement d’une autre espèce chimique qui en perd.
Une réduction ne peut donc pas se faire sans être accompagnée d’une oxydation: l’une accompagne toujours l’autre, si une réduction a lieu alors une oxydation se produit aussi en même temps.
Décrire une réduction par une demi-équation de réduction
Une réduction peut se décrire à l’aide d’une demi-équation de réduction.
Cette demi-équation traduit la transformation d’une espèce chimique réactive gagnant des électrons pour former un produit “réduit”.
Cette demi-équation de réduction suit les mêmes règles qu’une demi-équation d’oxydation (voir paragraphe sur l’oxydation) mais les électrons interviennent cette fois-ci à gauche de la flèche de réaction (du coté des réactifs).
Exemple
S + 2e–→ S2-
Cette demi-équation traduit la réduction du soufre atomique “S” en ions sulfure “S2-” par gain de de deux électrons.
Voir aussi cours “L’oxydation”
3. Oxydant
Définition
Un oxydant est une espèce chimique qui provoque l’oxydation d’une autre espèce au cours d’une transformation chimique.
Comment reconnaitre un oxydant ?
Par définition l’oxydant provoque une perte d’électrons chez une autre espèce chimique (puisqu’il l’oxyde) et ceci n’est possible que si lui-même “arrache” ces électrons.
Lors d’une transformation chimique un oxydant gagne des électrons, il se fait donc réduire.
Exemple
Lors de la transformation chimique décrite par l’équation de réaction suivante:
Cu2+ + Zn → Cu + Zn2+
On peut observer que:
- Le Zinc Zn perd deux électrons et se transforme en ion zinc Zn2+
- L’ion cuivre Cu2+ gagne deux électrons et se transforme en atome de cuivre Cu
Lors de cette transformation, il est possible d’arriver à la conclusion que l’ion cuivre joue le rôle d’oxydant de deux manières différentes:
- En faisant remarquer que le zinc subit une oxydation (puisqu’il perd des électrons) et que sont partenaire est nécessairement un oxydant.
- En faisant remarquer que l’ion cuivre gagne des électrons au cours de la transformation (il s’agit d’une caractéristique propre à un oxydant)
Voir aussi cours “L’oxydation”
4. Réducteur
Définition
Un réducteur est une espèce chimique qui provoque la réduction d’une autre espèce au cours d’une transformation chimique.
Comment reconnaitre un réducteur ?
Par définition un réducteur permet à une autre espèce chimique de gagner des électrons (puisqu’elle se fait réduire) et ces électrons sont fournis par le réducteur lui-même.
Lors d’une transformation chimique un réducteur perd des électrons, il se fait donc oxyder.
Exemple
Lors de la transformation chimique décrite par l’équation de réaction suivante:
Pb2+ + Zn → Pb + Zn2+
D’après cette équation de réaction:
- L’ion plomb Pb2+ est réduit puisqu’il gagne 2 électrons et forme un atome de plomb
- L’atome de zinc Zn est oxydé puisqu’il perd deux électrons et forme un ion zinc Zn2+
A cours de cette transformation chimique l‘atome de zinc Zn joue le rôle de réducteur puisque:
- Son partenaire (Pb2+) se fait réduire (il gagne des électrons)
- Il perd des électrons qui vont réduire une autre espèce chimique.
Voir aussi cours “L’oxydation”
5. Couples oxydant-réducteur
Définition
Si une espèce chimique “A” et une espèce chimique “B” forment un couple oxydant-réducteur noté (A/B) alors:
L’espèce chimique “A” est un oxydant qui peut former l’espèce chimique “B” par réduction en gagnant un nombre “n” d’électrons.
L’espèce chimique “B” est un réducteur qui peut former l’espèce chimique “A” par oxydation en perdant le même nombre “n” d’électron
Si (A/B) est un couple oxydant-réducteur alors on peut décrire la transformation de A en B ou de B en A par une demi-équation d’oxydoréduction de la forme:
A + ne– ⇌ B
On utilise, dans cette demi-équation, une double flèche au lieu d’une flèche simple afin de montrer que la transformation est possible dans les deux sens: L’oxydant (A) peut être réduit en B et le réducteur (B) peut être oxydé en A.
Si l’on précise que l’on souhaite écrire la demi-équation de réduction du couple A/B alors on notera: A + ne– → B
Pour la demi-équation d’oxydation on notera: B → A + ne–
Dans un couple oxydant-réducteur l’oxydant est toujours mentionné en premier et le réducteur en second.
On dit que les deux membres d’un même couple oxydant-réducteur sont des espèces chimiques conjuguées:
Voir aussi cours “L’oxydation”
6. Exemple du couple oxydant réducteur Ag+/Ag
Oxydant et réducteur du couple
- l’ion argent Ag+ est mentionné en premier (à gauche) il s’agit donc de l’oxydant
- l’atome d’argent Ag est mentionné en second (à droite) il s’agit donc du réducteur
On arrive à la même conclusion en comparant les charges électriques portées par chaque membre du couple:
Puisque l’ion argent Ag+ a une charge électrique plus élevée que l’atome d’argent (Ag) cela signifie que l’ion argent Ag+ possède moins d‘électrons que Ag par conséquent:
- L’ion argent Ag+ est susceptible de gagner des électrons, il est bien un oxydant.
- L’atome d’argent Ag est susceptible de perdre des électrons, il est bien un réducteur.
Espèces chimiques conjuguées du couple
On dit que l’argent Ag est le réducteur conjugué de l’ion Ag+ et inversement on dit que l’ion argent Ag+ est l’oxydant conjugué de l’argent Ag.
Demi-équations
La demi-équation d’oxydoréduction du couple Ag+/Ag est:
Ag+ + e–
⇌ Ag
La demi-équation de réduction du couple est:
Ag+ + e–
→ Ag
D’après cette équation l’ion argent Ag+ est un oxydant qui peut être réduit en gagnant un électron pour former un atome d’argent qui est la forme réduite et réductrice du couple.
La demi-équation d’oxydation du couple est:
Ag → Ag+ + e–
D’après cette demi-équation un atome d’argent est un réducteur qui peut se faire oxyder en perdant un électron pour former un atome d’argent Ag+ qui est la forme oxydée et oxydante du couple.
Voir aussi cours “L’oxydation”
7. Qu’est-ce qu’une oxydoréduction ?
Définition
Une oxydoréduction est une transformation chimique au cours de laquelle se déroulent simultanément une oxydation et une réduction.
Au cours d’une oxydoréduction:
- L’un des réactifs joue le rôle d’oxydant, il subit une réduction qui forme le réducteur conjugué de son couple oxydant-réducteur.
- Un autre réactif joue le rôle de réducteur, il subit une oxydation qui forme l’oxydant conjugué de son couple oxydant-réducteur.
Par conséquent lors d’une oxydoréduction il y a toujours parmi les réactifs au moins un oxydant et un réducteur.
Une réaction d’oxdoréduction fait toujours intervenir deux couples oxydant-réducteur:
- L’oxydant du couple n°1 réagit avec le réducteur du couple n°2
- L’oxydant se fait réduire et il oxyde le réducteur
- Il se forme le réducteur du couple n°1
- Il se forme l’oxydant du couple n°2
Règle importante:
Une réaction d’oxydoréduction n’est possible qu’entre l’oxydant d’un couple et le réducteur d’un autre couple.
Voir aussi cours “L’oxydation”
8. Equilibrage direct d’une équation d’oxydoréduction
Il est possible d’écrire une équation d’oxydoréduction équilibrée en suivant la méthode habituelle, c’est à dire:
- en indiquant les formules des réactifs à gauche et celle des produits à droite séparées d’une flèche pour symboliser la transformation.
- en ajoutant les coefficients stoechiométriques qui permettent de respecter la conservation des éléments chimiques et de la charge électrique.
Voir aussi cours “L’oxydation”
9. Exemple d’équilibrage direct: réaction des ions argent avec le cuivre métallique
En général on utilise la méthode de l’équilibrage direct dans des cas simples par exemple lors de la réaction des ions argent (Ag+) avec du cuivre (Cu).
L’ion argent fait partie du couple (Ag+/Ag) et sa réduction forme de l’argent Ag
Le cuivre fait partie du couple (Cu2+/Cu) par conséquent son oxydation forme l’ion cuivre Cu2+
L’équation non équilibrée de cette transformation s’écrit:
Ag+ + Cu → Ag + Cu2+
Dans cette équation “brute” il y a conservation des éléments chimiques mais pas celle de la charge électrique par conséquent. La logique veut que l’on commence par ajouter un coefficient “2” devant “Ag+” pour obtenir un total de deux charges électriques positives. Il y a alors la même charge totale pour les réactifs et les produits (2 charges positives de chaque coté)
L’équation de réaction devient alors:
2Ag+ + Cu → Ag + Cu2+
Cependant l’ajout de ce coefficient brise la conservation de la matière: il y a 2 éléments argent à gauche et un élément argent à droite.
Pour respecter la conservation de l’élément argent il faut ajouter un coefficient “2” devant l’atome d’argent Ag et l’équation devient donc:
2Ag+ + Cu → 2Ag + Cu2+
Cette équation est alors équilbrée.
La double conservation de la matière et de la charge électrique peut parfois être délicate à obtenir et l’équilibrage direct d’une équation d’oxydoréduction peut devenir complexe notamment lorsque des espèces chimiques du milieu réactionnel (comme l’eau, les ion hydrogène en milieu acide, les ions hydroxyde en milieu basique…) interviennent aussi.
Voir aussi cours “L’oxydation”
10. Méthode recommandée pour équilibrer une réaction d’oxydoréduction
L’écriture d’une équation d’oxydoréduction équilibrée se fait généralement en suivant la méthode suivante (on utilise l’exemple de la réaction d’oxydoréduction entre les ions argent Ag+ et l’aluminium métallique Al pour illustrer cette méthode):
- Identifier les deux couples oxydant-réducteur qui interviennent lors de la réaction.
L’ion argent Ag+ fait partie du couple Ag+/Ag tandis que l’aluminium Al fait partie du couple Al3+/Al
L’ion argent est l’oxydant du couple Ag+/Ag tandis que l’aluminium Al est le réducteur du couple Al3+/Al
Demi-équation de réduction de l’argent (qui est le réactif oxydant):
Ag+ + e–→ Ag
Demi-équation d’oxydation de l’aluminium (qui est le réactif réducteur)
Al→ Al3+ + 3e–
- Multiplier (si nécessaire) les membres de chaque demi-équation par un coefficient afin d’obtenir le même nombre d’électrons gagnés dans la demi-équation de réduction et d’électrons perdus dans la demi-équation d’oxydation.
Pour arriver au même nombre d’électrons échangés dans les deux demi-équations on multiplie par un coefficient “3” tous les membres de l’équation de réduction de l’argent ce qui donne:
Ag+ + e–→ Ag ) X3
3 Ag+ + 3e–→ 3Ag
De cette manière il y a 3 électrons gagnés lors de la réduction de l’argent mais aussi trois électrons perdus lors de l’oxydation de l’aluminium.
- Ajouter les deux demi-équations ainsi modifiées puis simplifier si nécessaire.
On rassemble dans une nouvelle équation les réactifs de la réduction de l’argent et ceux de l’oxydation de l’aluminium. On rassemble aussi dans cette même équation les produits des deux demi-équations.
Al→ Al3+ + 3e–
+ 3 Ag+ + 3e–→ 3Ag
_________________________
= Al + 3 Ag+ + 3e– → Al3+ + 3e– + 3Ag
- On simplifie en éliminant les membres de l’équation présents des deux cotés (dans les produits et dans les réactifs)
Dans notre exemple on peut simplifier en éliminant les électrons qui sont en même nombre (trois) parmi les réactifs et les produits.
Al + 3 Ag+ + 3e– → Al3+ + 3e– + 3Ag
Al + 3 Ag+ + → Al3+ + 3Ag
- Le résultat constitue l’équation équilibrée d’oxydoréduction.
Al + 3 Ag+ + → Al3++ 3Ag
Remarque importante:
Lorsqu’une oxydoréduction se déroule dans une solution aqueuse certaines espèces chimiques présentes en solution peuvent intervenir.
Il peut s’agir des molécules d’eau, des ions hydrogène (H+) en milieu acide ou des ions hydroxyde (OH–) en milieu basique.
Voir aussi cours “L’oxydation”
Avancement, tableau d’avancement et réactif limitant
11. Les coefficients stoechiométriques
Les coefficients stoechiométriques sont les nombres placés devant les formules chimiques pour équilibrer une équation de réaction.
Ils permettent donc de traduire les règles de conservation (des éléments chimiques et de la charge électrique)
Exemple
Dans l’équation de réaction suivante:
C3H8 + 5 O2 → 4 H2O + 3 CO2
- Le propane (C3H8) n’a pas de coefficient stoechiométrique (ce qui est équivalent à un coefficient “1”)
- Le dioxygène (O2) a comme coefficient stoechiométrique “5”
- L’eau (H2O) a comme coefficient stoechiométrique “4”
- Le dioxyde de carbone (CO2) a comme coefficient stoechiométrique “3”
Les coefficients stoechiométriques permettent de connaître en quelles proportions les réactifs sont consommés et les produits sont formés.
Ces proportions peuvent être établies en terme d’entités chimiques ou de quantité de matière
Exemple
La combustion du propane est décrite par l’équation suivante:
C3H8 + 5 O2 → 4 H2O + 3 CO2
D’après les coefficients stoéchiométriques de cette équation on peut dire:
- qu’il y a 5 fois plus de molécules de dioxygène consommées que de molécules de propane
- qu’il y a 1 mol de propane consommé pour 5 mol de dioxygène
- qu’il y a 2 mol de propane consommé pour 10 mol de dioxygène
- que pour 4 molécules d’eau formées il se forme 3 molécules de dioxyde de carbone
- qu’il se forme 4 mol d’eau pour 3 mol de dioxyde de carbone
- qu’il se forme 4 fois plus de molécules d’eau qu’il n y a de molécules de propane consommées
etc
Voir aussi cours “La stoechiométrie” – cours “Le système chimique“
12. Conditions stoechiométriques d’une transformation chimique
On dit qu’une transformation chimique a lieu dans des conditions stoechiométriques si les réactifs sont mélangés en des proportions correspondant aux coefficients stoechiométriques de l’équation de réaction.
Si une transformation chimique a lieu dans des conditions stoechiométriques alors on dit également que les réactifs sont dans des proportions stoechiométriques.
Exemple
La combustion du propane est décrite par l’équation suivante:
C3H8 + 5 O2 → 4 H2O + 3 CO2
Cette transformation se fait dans des conditions stoechiométriques si le mélange initial de réactif comporte cinq fois plus de dioxygène que de propane.
On a donc, par exemple, des conditions stoechiométriques si l’on fait réagir:
- 1 mol de popane et 5 mol de dioxygène
- 0,5 mol de propane et 2,5 mol de dioxygène
- 0,1 mol de propane et 0,5 mol de dioxygène
- 2 mol de propane et 10 mol de dioxygène
- 6 mol de propane et 30 mol de dioxygène
etc…
Lorsque la transformation chimique s’arrête il ne reste plus aucun réactif dans le milieu réactionnel (chacun a une quantité nulle !).
Voir aussi cours “La stoechiométrie”
13. Réactif limitant
Si les réactifs ne sont pas mélangés en proportions stoechiométriques alors quand la transformation chimique est finie:
Certains réactifs sont toujours présents dans le milieu réactionnel, ce sont des réactifs en excès
un ou plusieurs réactifs on été entièrement consommés, il s’agit du ou des réactifs limitants.
Un réactif limitant est une espèce chimique qui est entièrement consommée lors de la transformation chimique.
Si un réactif est limitant alors sa quantité de matière finale est nulle (égale à zéro)
Pour savoir si un réactif est limitant on peut:
- vérifier qu’il n’en reste plus lorsque la transformation chimique est finie.
- le prévoir à partir des quantités de réactifs initiales et des coefficients stoechiométriques des réactifs.
- utiliser l’avancement (voir paragraphes suivants)
Voir aussi cours “La stoechiométrie” – “L’avancement de la réaction”
14. L’avancement de la réaction
L’avancement d’une réaction:
L’avancement de la réaction est une grandeur fictive qui représente la quantité de matière qui serait consommée pour un réactif de coefficient stoechiométrique “1” (donc sans coefficient stoechiométrique apparent dans l’équation).
- Au moment où la transformation chimique commence la quantité de réactif n’a pas encore commencé à évoluer par conséquent l’avancement est nul (x = 0).
- Lorsque la transformation chimique se termine l’un ou la totalité des réactifs ont été entièrement consommés et l’avancement atteint alors sa valeur maximale notée xmax.
- Entre ces deux extrémités (le début et la fin de la réaction) l’avancement prend des valeurs intermédiaires entre “0” et xmax.
Au début d’une transformation chimique l’avancement est nul (x=0) et lorsqu’elle se termine il atteint sa valeur maximale (xmax)
Voir aussi cours “L’avancement”
15. Utiliser l’avancement pour exprimer une quantité de matière
Pour chaque espèce chimique (réactifs et produits) il est possible d’exprimer la quantité au cours de la transformation chimique en fonction de l’avancement.
- Réactif de coefficient stoechiométrique “1”
Un réactif de coefficient stoechiométrique “1” serait par définition consommé d’une valeur équivalente à l’avancement “x”.
Si sa quantité de matière initiale était n0 alors sa quantité de matière au cours la réaction est donc n = n0 – x
- Réactif de coefficient stoechiométrique “a”
Si un réactif possède un coefficient stoechiométrique “a” alors la quantité de réactif consommée au cours de la réaction est “a” fois plus grande que celle d’un réactif de coefficient “1”. La quantité de réactif consommée est donc a.x ( “a” fois “x”).
Si la quantité de matière initiale de ce réactif est n0 sa quantité restante est n = n0 – a.x
- Produit de coefficient stoechiométrique “1”
Au cours d’une transformation la quantité formée d’un produit de coefficient “1” est la même que la quantité consommée pour un réactif de coefficient “1” et cette quantité correspond à la valeur de l’avancement.
Par conséquent la quantité de ce produit au cours de la transformation chimique est n = x
- Produit de coefficient stoechiométrique “a”
Il se forme “a” fois plus d’un produit de coefficient “a” que d’un produit de coefficient “1” ( qui lui-même a une quantité de matière n = x)
La quantité de matière est donc n = a.x.
Voir aussi cours “L’avancement”
16. Tableau d’avancement
Pour toute transformation chimique il est possible de présenter l’évolution des différentes quantités de matière sous forme d’un tableau d’avancement.
- La première ligne comporte l’équation de réaction équilibrée
- La seconde ligne précise l’ “état du système”, c’est à dire le nom des grandeurs exprimées et éventuellement l’unité choisie (souvent mole ou millimole). On trouve en général dans cette ligne l’avancement, la quantité de réactif n°1 n(réactif1), la quantité de réactif n°2 (n(réactif2)… la quantité de produit n°1 n(produit1), la quantité de produit 2 n(produit2)…
La valeur ou l’expression de ces grandeurs est ensuite précisée pour chaque réactif et produit lors de trois étapes de la transformation chimique:
- L’état initial, c’est à dire à l’instant t = 0 où les réactifs sont mis en présence mais n’ont pas encore commencé à réagir, l’avancement est alors nul.
- Un état intermédiaire quelconque entre le début et la fin de la transformation chimique. Une partie des réactifs a déjà été consommée mais aucun n’a entièrement disparu. La valeur de l’avancement est simplement “x”
- L’état final, c’est à dire le moment où la transformation s’achève. Au moins l’un des réactifs a été entièrement consommé et il ne se forme plus de produit, l’avancement est maximal, x = xmax
Exemple

Voir aussi cours “Tableau d’avancement“
17. Trouver le réactif limitant et l’avancement maximal
Pour trouver le réactif limitant et l’avancement maximal xmax ont fait à tour de rôle l’hypothèse que chaque réactif est le réactif limitant.
Si le réactif n°1 est limitant alors sa quantité finale est nulle, on peut donc écrire que la quantité exprimée dans la dernière ligne du tableau d’avancement est égale à 0.
Si la quantité finale de réactif s’exprime par la relation n = n0(Reactif1) – a1.x (a1 est le coefficient stoechiométrique du réactif 1) alors dans le cas où il est limitant on peut écrire:
n0(Reactif1) – a1.xmax = 0 (puisque la quantité finale d‘un réactif limitant est nulle)
On en déduit l’expression de l’avancement maximal:
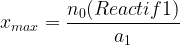
Si le Si le réactif n°2 est limitant, en suivant la même démarche on obtient:
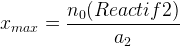
De même s’il y a un troisième réactif:
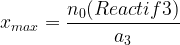
Parmi les résultats obtenus pour xmax:
- La plus petite valeur est la valeur réelle de l’avancement maximal
- Elle est obtenue pour le réactif jouant réellement le rôle de réactif limitant.
Le réactif limitant d’une transformation chimique est celui qui permet d’aboutir à la plus petite valeur de l’avancement maximal.
Voir aussi cours “L’avancement de la réaction”
A réviser
- Le système chimique
- Les transformations chimiques
- Les réactifs d’une transformation chimique
- Les produits d’une transformation chimique
- Ecrire et équilibrer une équation de réaction
Les autres cours de première spécialité
- Quantité de matière, masse molaire et concentration
- Réaction d’oxydoréduction et avancement
- Titrage colorimétrique redox
- Schéma de Lewis, géométrie, électronégativité et polarisation
- Cohésion des solides, dissolution, solubilité, hydrophilie et lipophilie
- Structure et nomenclature des espèces organiques
- Synthèse organique
Pour approfondir et découvrir
Exercices corrigés sur l’oxydoréduction (académie de Paris)
