Cours de chimie – niveau classe de première S – partie « Couleurs et images – Matières colorées » (structure et propriétés de la matière)
- Liaison simple et libre rotation
- Double liaison et blocage de la rotation
- Isomérie: rappels
- Définition de l’isométrie Z/E
- Isomère Z
- Isomère E
- Isomérie Z/E dans les molécules cycliques
- Différences et points communs entre isomères Z et E
Liaison simple et libre rotation
Lorsque deux atomes centraux établissent entre eux une liaison simple alors une rotation est possible autour de l’axe de cette liaison. Sous l’effet, de l’agitation thermique les groupements liés aux atomes centraux sont en constante rotation et leur orientation relative ne cesse d’évoluer.
Double liaison et blocage de la rotation
Lorsque des atomes ne sont plus liés par une liaison simple mais par une liaison double alors la rotation n’est plus possible. En raison de ce blocage, les groupements liés à ces atomes conservent la même disposition spatiale les uns par rapport aux autres.
La situation la plus courante est celle où les atomes doublement liés sont des atomes de carbone qui forment chacun deux autres liaisons simples. Chacun de ces carbones possède alors une géométrie triangulaire plane et il en résulte une molécule où les deux carbones ainsi que tous les atomes auxquels ils sont liés appartiennent au même plan.
Par exemple dans une molécule de chloroéthylène C2H3Cl de formule développée:
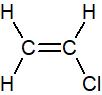
Les atomes de carbone, d’hydrogène ainsi celui de chlore sont tous dans le même plan et le blocage de la rotation par la double liaison maintient cette disposition. Si la molécule est observée suivant l’axe de la liaison carbone-carbone alors:
- le chlore du premier carbone semble se superposer en permanence à un hydrogène du deuxième
- l’hydrogène du premier carbone semble se superposer à l’autre hydrogène du deuxième carbone
La situation peut être visualisée à du modèle moléculaire suivant:

Isomérie: rappels
Deux espèces sont dites isomères si elles ont la même formule brute (la même composition atomique) mais ont des formule développées différentes (l’enchaînement des atomes est différent)
Définition de l’isométrie Z/E
On dit qu’il y a isomérie Z/E entre deux espèces chimiques si:
- elles sont isomères
- elles comportent deux carbones doublement liés entre eux
- ces deux carbones sont liés chacun à un hydrogène et à un autre atome ou groupement.
- si l’une de ces espèces a les deux hydrogènes du même côté de la double liaison alors qu’ils sont sur des côtés opposés chez l’autre espèce chimique.
Remarque
Le programme de première S se limite à un cas particulier d’isomèrie où deux des groupements sont nécessairement des atomes d’hydrogène mais il est possible de généraliser cette notion à n’importe quel type de groupement pourvu qu’il y en ai au moins deux sortes différentes.
Isomère Z
La lettre Z est la première lettre du mot allemand zuzamen qui signifie “ensemble”
Un isomère est de type Z si les deux hydrogènes sont du même côté de la double liaison.
Il aura donc toujours une formule développée du type:
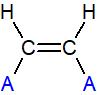
Ou
Isomère E
La lettre E est la première lettre du mot allemand entgegen qui signifie “opposés”
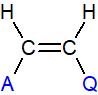
Un isomère est de type E si les deux hydrogènes ne sont pas du même côté de la double liaison.
Il a donc toujours une formule du type
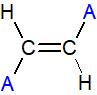
Ou
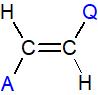
Isomérie Z/E dans les molécules cycliques
Lorsqu’une double liaison est établie entre les deux carbones d’un cycle alors la contrainte géométrique qui en découle implique que seul l’un des isomères Z ou E peut effectivement exister même si toutes les conditions de l’isomère Z/E sont réunies.
Par exemple le cyclohexène de formule C6H10 à toujours pour formule développée :
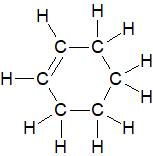
Il existe uniquement sous forme d’isomère Z car pour être inclus dans un cycle les groupements carbonés doivent être du même coté de la double liaison.
Différences et points communs entre isomères Z et E
Par définition deux isomères Z et E ont la même formule brute et donc la même composition atomique ainsi que la même masse molaire.
Par contre la différence entre leur structures peut impliquer des différences de:
- température de changement d’état ( fusion et ébullition)
- de masse volumique
- de densité
- de solubilité
- de réactivité chimique
Notions de seconde à réviser
- Les formules brutes
- Les formules développées
- Les formules semi-développées
- Les modèles moléculaires
- Les isomères
