Ce cours correspond à la partie ” Détermination d’une quantité de matière grâce à une transformation chimique ” du programme de physique-chimie de première spécialité.
Il est situé dans la partie du programme “Constitution et transformations de la matière – Suivi de l’évolution d’un système, siège d’une transformation”
- Qu’est-ce qu’un dosage ?
- Qu’est-ce qu’un titrage
- Définition des termes utilisés pour décrire un titrage
- Principe d’un dosage par titrage
- Repérer l’équivalence
- Utiliser le volume équivalent pour calculer une concentration ou une quantité de matière
- Réalisation expérimentale d’un titrage colorimétrique
A réviser – Les autres cours de première spécialité – Pour approfondir et découvrir
Qu’est-ce qu’un dosage ?
Un dosage est une technique qui permet de déterminer la quantité de matière ou la concentration d’une espèce chimique dissoute dans une solution aqueuse.
Qu’est-ce qu’un titrage ?
Un titrage est un dosage particulier, il permet donc de trouver la concentration ou la quantité de matière d’un soluté en exploitant une réaction avec une autre espèce chimique.
Définition des termes utilisés pour décrire un titrage
- L’espèce chimique dont la quantité de matière (ou concentration) est inconnue est appelée espèce chimique titrée.
- La solution aqueuse dans laquelle est dissoute l’espèce chimique titrée est appelée solution titrée.
- L’espèce chimique avec laquelle réagit l’espèce titrée est appelée espèce chimique titrante.
- La solution dans laquelle est dissoute l’espèce chimique titrante est appelée solution titrante.
- La réaction qui a lieu entre l’espèce titrée et l’espèce titrante est appelée réaction support.
Principe du titrage colorimétrique
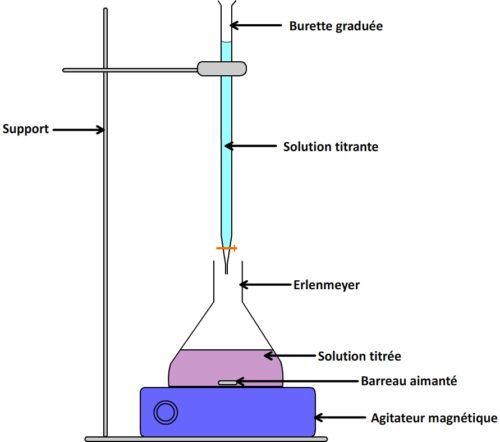
La solution à titrer est placée dans un récipient ( un bécher ou le plus souvent un erlenmeyer) et subit une agitation régulière grâce à un barreau aimanté mis en rotation par un agitateur magnétique. Cette agitation permet d’homogénéiser le mélange et de disperser rapidement la solution titrante dans la solution titrée au fur et à mesure qu’elle est ajoutée.
La solution titrante est placée dans une burette entièrement remplie (jusqu’à la graduation zéro) qui permet d’ajouter progressivement un volume connu de solution titrante.
La solution titrante est ajoutée progressivement dans la solution titrée: il y a réaction chimique entre l’espèce titrée et l’espèce titrante tant que l’espèce titrée n’est pas entièrement consommée.
Lors de l’ajout de solution titrante on peut distinguer trois phases qui dépendent de la quantité d’espèce titrée ajoutée:
- Tant que l’espèce titrante constitue le réactif limitant de la réaction support elle est entièrement consommée, l’espèce titrée n’est quant à elle que partiellement consommée.
- Lorsque la quantité d’espèce titrée permet d’atteindre précisément les conditions stoechiométriques les deux espèces chimiques (titrée et titrante) sont entièrement consommées.
- Lorsque l’espèce titrée devient le réactif limitant elle est entièrement consommée et une partie de l’espèce titrante ajoutée subsiste dans le milieu réactionnel.
L’étape intermédiaire lors de laquelle l’espèce titrante est ajoutée à l’espèce titrée en des proportions qui permettent d’atteindre les conditions stoechiométriques est appelée point d’équivalence.
Le volume total de solution titrante ajoutée au point d’équivalence est appelé volume équivalent et il est noté Veq ou VE.
Repérer l’équivalence
Un dosage colorimétrique doit permettre de repérer facilement le point d’équivalence et de déterminer avec une précision suffisante le volume équivalent.
Par définition un titrage colorimétrique exploite un changement de couleur du mélange constitué par la solution titrée et la solution titrante lorsque l’équivalence est atteinte.
Ce changement ne peut survenir que si l’espèce chimique titrée ou l‘espèce chimique titrante est colorée.
- Cas où seule l’espèce chimique titrée est colorée
La solution titrée est initialement colorée, lorsque l’espèce chimique titrante est ajoutée elle réagit avec l‘espèce titrée colorée qui se transforme progressivement en produit non coloré.
Avant l’équivalence l’espèce chimique titrée colorée reste en excès et malgré sa disparition partielle elle continue à colorer la solution. Par contre, à l’équivalence elle est entièrement consommée, la solution titrée devient alors incolore et cette décoloration permet de repérer facilement l’équivalence.
Si seule l’espèce titrée est colorée alors le point d’équivalence se repère grâce à une décoloration de la solution titrée.
La goutte de solution titrée provoquant une décoloration indique que le volume de solution titrante ajouté correspond au volume équivalent.
- Cas où seule l’espèce titrante est colorée
Dans la première phase du titrage l’espèce chimique titrante est le réactif limitant, elle est donc entière consommée par la réaction chimique qui a lieu avec l’espèce chimique titrée:
Tant que le point d’équivalence n’est pas atteint le mélange réactionnel reste donc incolore.
Au point d’équivalence la totalité de l’espèce chimique titrée a réagit, il n’en reste plus en solution.
Dés que le point d’équivalence est dépassé, ne serait-ce que d’une seule goutte, l’espèce chimique titrante n’est plus consommée et elle donne sa couleur au mélange réactionnel.
Si seule l’espèce titrante est colorée alors le point d’équivalence se repère à la persistance de la coloration dans la solution titrée.
Utiliser le volume équivalent pour calculer une concentration ou une quantité de matière
Par définition, lorsque l’équivalence est atteinte les réactifs sont mélangés en des proportions stoechiométriques: ils sont tous les deux consommés et l’avancement maximal de la solution est atteint.
Si l’on suppose que:
- l’espèce titrée est qualifiée d’espèce chimique n°1 et l’espèce chimique titrante d’espèce chimique n°2 (pour faciliter les notations)
- Dans l’équation de réaction l’espèce titrée possède un coefficient stoechiométrique a1 et l’espèce titrante un coefficient a2.
- La concentration (recherchée) de l’espèce chimique 1 est C1 (et sa quantité de matière initiale n1)
- La concentration (connue) de l’espèce chimique 2 est C2 ( et sa quantité de matière initiale n2)
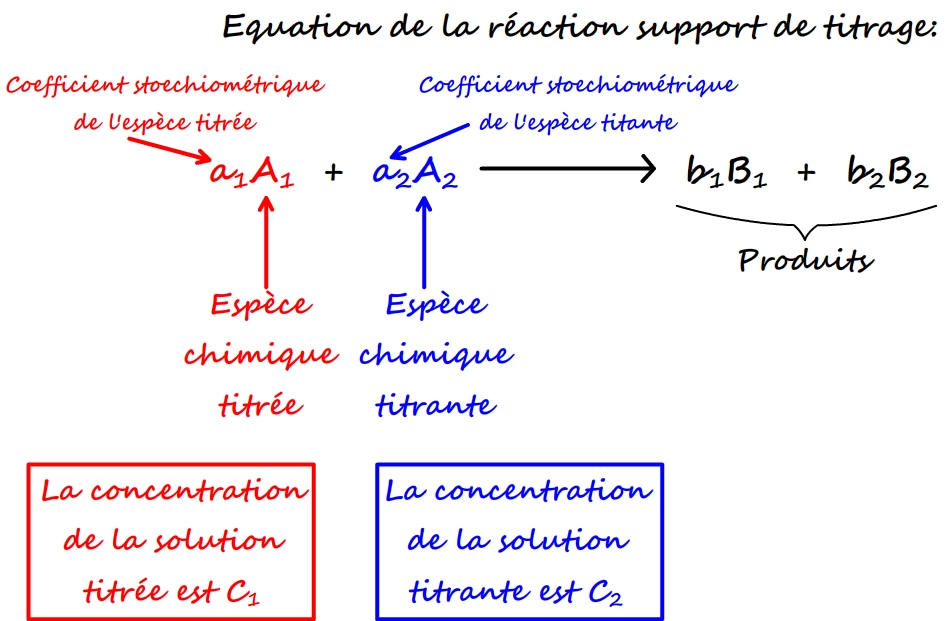
Lorque l’équivalence est obtenue la quantité de matière des deux espèces (titrée et titrante) est nulle dans le mélange réactionnel et l’on peut écrire:
- Pour l’espèce titrée n = 0 = n1 – a1.xmax
On en tire une expression de l’avancement maximal:
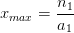
- Pour l’espèce titrante: n = 0 = n2 – a2.xmax
On en tire une deuxième expression de l’avancement maximal:
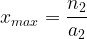
On en déduit l’égalité entre ces deux expressions:
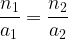
on en déduit l’expression de n1:
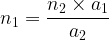
Remarque
Pour de nombreuses réactions support les coefficients stoechiométriques sont égaux à “1” et dans ce cas la relation entre les quantités de matière est la suivante: n1 = n2
Ce qui signifie que la quantité d’espèce titrante versée à l’équivalence est égale à la quantité d’espèce titrée présente dans la solution titrée.
n2 correspond à la quantité de matière ajoutée à l’équivalence, on peut l’exprimer à partir du volume équivalent et de la concentration de la solution titrante:
n2 = C2.VE
On en déduit donc la quantité de matière de l’espèce titrée:
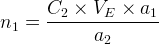
Soit
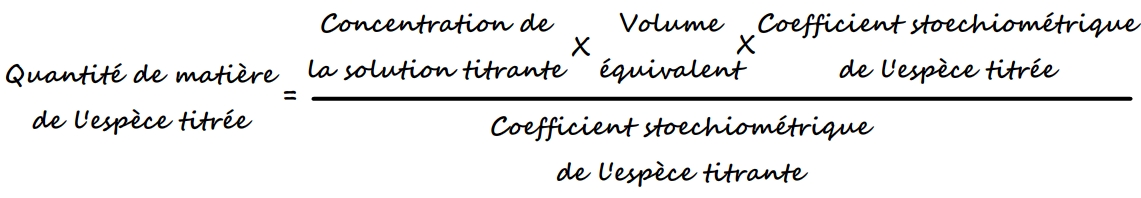
La quantité de matière de l’espèce titrée peut aussi être exprimée par la relation
n1 = C1.V1
la relation précédente devient donc:
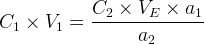
La concentration de la solution titrée est donc donnée par la relation:
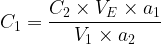
En résumé
- L’espèce n°1 (titrée) A1 de coefficient stoechiométrique a1 a une concentration C1 dans la solution titrée et une quantité de matière n1
- L’espèce n°2 (titrante) A2 de coefficient stoechiométrique a2 a une concentration C2 dans la solution titrante.
- A l’équivalence le volume de solution titrante ajouté est VE, il contient une quantité de matière n2.
- Relation entre n1 et n2 :
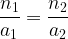
- Expression de n2: n2 = C2.VE
- Expression de n1:
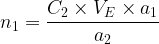
- Expression de la concentration de la solution titrée:
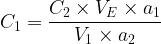
Réalisation expérimentale d’un titrage colorimétrique
- Préparation de la solution titrante
Elle est versée en excès (en dépassant le zéro) dans une burette graduée. On laisse ensuite l’excès de solution s’écouler en ouvrant le robinet jusqu’à ce que le bas du ménisque de la solution soit au niveau de la graduation “zéro”.
- La solution: titrée
Elle est prélevée à l’aide d’une pipette jaugée (afin de disposer d’un volume de solution connu précisément) et versée dans un erlenmeyer (dont le col permet d’éviter les pertes par projection lors de l’agitation).
On ajoute dans cet erlenmeyer un barreau aimanté (pour l’agitation) et l’ensemble est placé sur un agitateur magnétique.
- Réalisation du dosage
La solution titrante est mise sous agitation et la solution titrante est ajoutée progressivement.
Lorsqu’on observe l’apparition d’une coloration (si l’espèce titrante est colorée) ou une décoloration (si l’espèce titrée est colorée) alors le volume versé correspond au volume équivalent.
Souvent un titrage colorimétrique est réalisé deux fois: la première est un titrage rapide qui permet de repérer approximativement la valeur du volume équivalent tandis que le deuxième titrage est plus précis grâce à un débit ralenti lors de l’approche du volume équivalent.
A réviser
Cours de seconde sur la transformation chimique:
- Les transformations chimiques
- Les réactifs d’une transformation chimique
- Les produits d’une transformation chimique
- Ecrire et équilibrer une équation de réaction
- Stoechiométrie
Cours de première sur l’oxydoréduction et les transformations chimiques:
- Suivi et modélisation de l’évolution d’un système chimique
- L’oxydation
- Le système chimique
- L’avancement de la réaction
- Tableau d’avancement
Les autres cours de première spécialité
- Quantité de matière, masse molaire et concentration
- Réaction d’oxydoréduction et avancement
- Titrage colorimétrique redox
- Schéma de Lewis, géométrie, électronégativité et polarisation
- Cohésion des solides, dissolution, solubilité, hydrophilie et lipophilie
- Structure et nomenclature des espèces organiques
- Synthèse organique
Pour approfondir et découvrir
- “Titrage avec un suivi colorimétrique” – pdf – fiche de cours de l’académie de Guyane.
- “Réaliser un dosage colorimétrique en 8 étape” – pdf – Méthode détaillée et illustrée expliquant la méthode à suivre pour réaliser un dosage colorimétrique – Document du lycée Gallois dans l’académie de Versailles.
