Cours de chimie niveau seconde – Constitution et transformations de la matière – Partie 1: de l’échelle macroscopique à l’échelle microscopique – B) Modélisation de la matière à l’échelle microscopique – Le noyau de l’atome, siège de sa masse et de son identité
- Forme et limites d’un atome
- Ordre de grandeur du noyau
- Ordre de grandeur de l’atome
- Comparaison de la taille du noyau et de l’atome
- Rayons atomiques
Forme et limites d’un atome
Un atome est constitué d’un noyau entouré d’un cortège d’électrons:
- Le noyau est un agrégat de nucléons (protons et neutrons) que l’on peut considérer comme sphérique .
- L’atome dans son ensemble peut lui aussi être modélisé par une sphère.
La limite d’un atome correspond à la zone où évoluent les électrons les plus éloignés de son noyau: il s’agit de la couche de valence (aussi appelée couche externe) où évoluent les électrons de valence.
Ordre de grandeur du noyau
Le plus petit noyau atomique est celui de l’hydrogène constitué d’un seul et unique proton dont le noyau a un diamètre de 1,68.10-15 m.
L’uranium est un des plus lourd élément chimique stable, les noyaux de ses isotopes stable ont un diamètre de l’ordre de 2.10-14 m*1.
On retient que le diamètre d’un atome est toujours de l’ordre de:
10-15 m (1 femtomètre)
*1 Source: Livret thématique du CEA “L’atome” http://www.cea.fr/multimedia/Documents/publications/livrets-thematiques/livret-atome.pdf
Ordre de grandeur de l’atome
L’un des plus petit atomes est l’hydrogène, il a un diamètre de 0,5.10-10 m
L’un des plus gros atome est l’actinide, son rayon de 2,9.10-10 m
On retient donc que l’ordre de grandeur du diamètre d’un atome est de
10-10 m (1 angrström)
Comparaison de la taille du noyau et de l’atome
Le rapports des ordres de grandeur du diamètre de l’atome et de son noyau est:
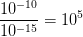
L’atome est donc environ 100 000 fois plus grand que son noyau !
Sachant que la dimension des électrons est très faible (un électron est si petit qu’il est difficile de déterminer sa taille) on en déduit que la matière est très minoritaire et qu’un atome est essentiellement constitué de vide. Pour traduire cette caractéristique on dit que l’atome a une structure “lacunaire“.
Rayons atomiques
Les tables de données fournissent en général le rayon des atomes et non leur diamètre. Ce dernier peut être déterminé de manière théorique (en se basant sur des modèles plus ou moins complexes) ou expérimentalement en considérant que le rayon atomique correspond à la moitié de la distance séparant les noyaux de deux atomes identiques liés par une liaison covalente.
(Voir tableau des rayons atomiques: https://fr.wikipedia.org/wiki/Rayon_atomique)
Les variations du rayon atomique au sein du tableau périodique suivent les variations de distance entre le noyau et sa couche externe:
- Sur une ligne du tableau périodique (de gauche à droite) la couche externe reste la même mais la charge du noyau augmente et son attraction sur le cortège électronique devient de plus en plus intense par conséquent la couche externe se rapproche du noyau et le rayon atomique diminue.
- Sur une colonne du tableau périodique (de haut en bas) chaque élément possède une couche externe plus élevée que l’élément précédent par conséquent la rayon atomique augmente.
