Cours de chimie – niveau classe de première S – partie « Couleurs et images – Matières colorées » (structure et propriétés de la matière)
- Répartition des doublets d’électrons
- Trouver la géométrie d’une molécule simple
- Exemple géométrie d’une molécule de méthane
- Exemple géométrie de la molécule d’ammoniaque
- Exemple: géométrie de la molécule d’eau
- Géométrie linéaire
- Géométrie plane
- Géométrie tétraédrique
- Géométrie pyramidale
- Géométrie coudée
- Résumé: trouver la géométrie à partir du nombre de doublets liants et non liant
- Géométries idéales et réelles
Les liaison de covalentes établies par un atome pointent toujours dans une direction bien déterminée (dictée par des critères de stabilité) ce qui impose aux atomes (ou au groupements d’atomes) qui lui sont liés une répartition spatiale précise. Il est ainsi possible de décrire la géométrie adoptée par des atomes liés à un atome central.
Répartition des doublets d’électrons
Les doublets (qu’ils soient liant ou non) sont par définition constitués d’une paire d’électron qui leur confèrent une charge électrique négative. Par conséquent ces doublets exercent entre eux des force électriques répulsives et leur répartition la plus stable coïncide avec un éloignement maximum des doublets liants et non liants entre eux.
C’est ce principe d’éloignement maximum des doublets qui est utilisé pour prévoir leur répartition et la géométrie des molécules.
Remarque: ce principe est connu sous le nom de principe VSEPR (Valence Shell Electron Pair Répulsion ce qui peut se traduire par ” répulsion des doublets d’électrons de la couche externe)
Trouver la géométrie d’une molécule simple
Première étape : déterminer le nombre de directions différentes dans lesquelles pointent les doublets de l’atome central
Une direction distincte est associée à chaque:
- Doublet non liant
- Liaison covalente simple
- Liaison covalente double
- Liaison covalente triple
- si un atome a 4 liaisons simples elles correspondent à 4 directions.
- si un atome a 3 liaisons simples et un doublet non liant alors ils correspondent aussi à 4 directions.
- si un atome forme une double liaisons, une liaisons simple et à un doublet non liant alors le nombre total de directions est de 3
Deuxième étape: déterminer la répartition spatiale de tous les doublets
Cette répartition dépend du nombre total de directions dans lesquelles pointent les doublets non liants et les liaisons. En verte du principe d’éloignement maximum des doublets on peut systématiquement associer:
- une répartition tétraédrique à quatre directions différentes ( les extrémités des doublets et liaisons constituent une forme géométrique tétraédrique)
- une répartition triangulaire plane à trois directions différentes.
- une répartition linéaire pour deux directions
Troisième étape: déterminer la géométrie de la molécule
Cette géométrie est définie par la répartition spatiale des atomes et groupements liés à l’atome central mais elle ne tient pas compte des doublets non liants.
La géométrie de la molécule est déduite de la répartition obtenue à l’étape deux. Il suffit d’ “effacer” de cette répartition les doublets non liants.
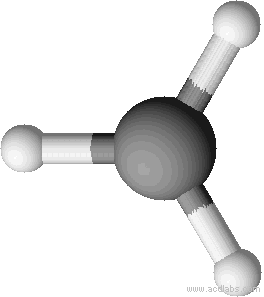
Exemple géométrie d’une molécule de méthane
Le méthane à pour formule brute CH4
L’atome de carbone central forme 4 liaisons simples avec chacun des 4 hydrogènes, les 4 doublets liants pointent dans 4 directions différentes et se répartissent suivant un tétraèdre
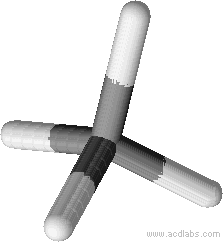
Puisqu’il n’y a pas de doublet non liant la géométrie de la molécule est elle-même tétraédrique.
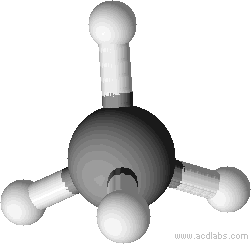
Exemple géométrie de la molécule d’ammoniaque
L’ammoniaque à pour formule brute NH3, l’atome d’azote central forme 3 liaisons simples avec les hydrogène et possède un doublet non liant. Il y a au total 4 doublets (3 liant et un non liant) qui pointent dans 4 directions différentes et se répartissent de manière tétraédrique.
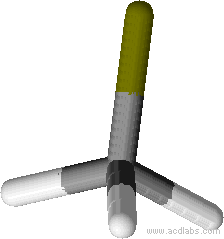
Le doublet non liant n’intervient pas dans la géométrie moléculaire

La géométrie finale est pyramidale car elle n’inclut que l’azote central et les trois hydrogènes qui lui sont liés.
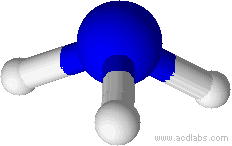
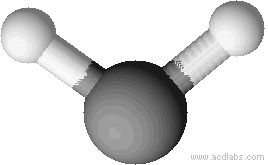
Exemple: géométrie de la molécule d’eau
La molécule d’eau a pour formule brute H2O, l’atome central est l’oxygène qui établit deux liaisons simples avec deux atomes d’hydrogène et possède deux doublets non liants. Les 4 doublets (deux liants et deux non liants) sont disposés suivant une répartition tétraédrique.

Les deux doublet non liant n’interviennent pas dans la géométrie finale
La géométrie réelle de la molécule est définie seulement par l’oxygène et les deux hydrogène qui forment une sorte de lettre V, on dit qu’il s’agit d’une géométrie coudée.

Géométrie linéaire
L’atome central est lié à deux autres atomes avec lesquels il est aligné, les liaisons pointent dans deux directions opposées et forment donc un angle de 180 degrés.
Elle n’est possible que si l’atome central :
- n’a pas de doublet non liant
- forme soit deux doubles liaisons, soit une triple et une simple liaison.

Exemples: le dioxyde de carbone, l’acide cyanhydrique.
Géométrie plane
L’atome central est lié à trois autres atomes tous situés dans le même plan et disposés aux sommets d’un triangle. Les trois liaisons sont coplanaires et forment entre elles des angles de 120 degrés.
Elle n’est possible que si l’atome central:
- n’a pas de doublets non liants
- forme une double liaisons et deux liaisons simples
Exemple: l’éthylène, le carbone central de l’acétone.
Géométrie tétraèdrique
L’atome central est lié à quatre autres atomes situés aux sommets d’un tétraèdre. Les liaisons forment toutes entres elles des angles d’environ 109 degrés.
Cette géométrie tétraèdrique n’est possible que si l’atome central:
- n’a pas de doublets non liants
- forme quatre liaisons simples

Exemples: le méthane, le méthanol
Géométrie pyramidale
L’atome central est lié à trois autres atomes, et forme avec ces derniers une pyramide à base triangle dont ils sont les sommets. L’atome central constitue le sommet supérieur de la pyramide tandis que les trois autres sont les sommets de la base rectangle. Les liaisons forment entre elles des angles de 109 degrés.
Une géométrie pyramidale n’est possible que si l’atome central :
- porte un doublet non liant
- forme trois liaisons simples
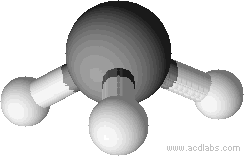
Exemple: l’ammoniac
Géométrie coudée
L’atome central est lié à deux autres atomes mais ils ne sont pas alignés (contrairement aux atomes d’une molécule linéaire). La molécule à la même forme que la lettre V, et les deux liaisons forment un angle d’environ 109 degrés.
La géométrie coudée n’est possible que si l’atome central:
- possède deux doublets non liants
- forme deux liaisons simples.
Exemples: l’eau, le sulfure d’hydrogène
Résumé: trouver la géométrie à partir du nombre de doublets liants et non liant
Pour les éléments des trois premières périodes du tableau périodique respectant la règle de l’octet on peut déterminer la géométrie adoptée simplement à partir du nombre de doublets non liants et des liaisons formées.
- quatre liaisons simples + aucun doublet non liant = géométrie tétraédrique
- deux liaisons simples + une liaison double + aucun doublet non liant = géométrie triangulaire plane.
- une liaison simple + une liaison triple + aucun doublet non liant = géométrie linéaire.
- trois liaisons simples + un doublet non liant = géométrie pyramidale
- une liaison simple + une liaison double + un doublet non liant = géométrie coudée
- deux liaisons simples + deux doublets non liants = géométrie coudée.
Géométries idéales et réelles
Les géométrie décrites sont des géométries “idéales” prévues en faisant l’approximation que toute les répulsions sont équivalentes mais la géométrie réelle peut s’en écarter car la répulsion n’est pas exactement la même suivant:
- que les liaisons sont simples ou multiples
- que les doublets sont liants ou non liants.
- suivant l’ “encombrement” des groupements liés à l’atome central.
