Analyser un système chimique par des méthodes physiques – Constitution et transformations de la matière – 3. Prévoir l’état final d’un système, siège d’une transformation chimique- C) Forcer le sens d’évolution d’un système
- Rappel sur les transformations chimiques spontanées
- Comment forcer une transformation chimique ?
- L’électrolyseur et son fonctionnement
- Quantité d’électrons échangés lors d’une électrolyse
- Variation de quantité de matière lors d’une électrolyse
- Stockage et conversion de l’énergie chimique


Rappel sur les transformations chimiques spontanées
Toute transformation chimique est caractérisée par une constante d’équilibre « Ke ».
Si un système chimique possède un quotient de réaction QR dont la valeur est différente de celle de la constante d’équilibre, alors ce système est le siège d’une transformation chimique spontanée.
En particulier si QR < Ke alors la transformation chimique a lieu dans le sens direct et le quotient de réaction QR augmente au cours de cette transformation qui ne prend fin que lorsque les deux valeurs sont égales, c’est-à-dire QR = Ke.
Par exemple, si l’on considère les couples oxydant-réducteurs Zn2+/Zn et I2/I–, alors :
- le diiode (I2) peut jouer le rôle d’oxydant selon la demi-équation I2 + 2e– → 2I–
- le zinc (Zn) peut jouer le rôle de réducteur suivant la demi-équation Zn → Zn2+ + 2e–
Il peut alors se produire la réaction spontanée suivante :
Zn + I2 → Zn2+ + 2I–
Cette réaction spontanée est possible tant que QR < Ke, avec
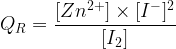
et Ke = 1046 à une température de 25 degrés Celsius.
Comment forcer une transformation chimique ?
Une transformation chimique est dite forcée si elle peut se produire dans le sens inverse d’une transformation chimique spontanée.
Par conséquent, lors d’une transformation chimique forcée, le quotient de réaction s’éloigne de la constante d’équilibre au lieu de s’en approcher (en général, il diminue au lieu d’augmenter).
Exemple de transformation forcée :
2I– + Zn2+ → Zn + I2
Il s’agit de la transformation inverse de celle vue au paragraphe précédent.
Lors d’une transformation chimique forcée, une forme d’énergie (électrique, de rayonnement…) est convertie en énergie chimique.
Au cours d’une transformation spontanée, c’est l’inverse : l’énergie chimique est convertie en une autre forme d’énergie (souvent thermique).
En pratique, il est courant de provoquer une transformation chimique forcée à l’aide d’un générateur électrique connecté à un électrolyseur.
L’électrolyseur et son fonctionnement
L’électrolyseur est un dispositif destiné à être connecté à un générateur afin d’y réaliser une électrolyse c’est à dire une réaction d’oxydoréduction forcée. Il est constitué d’une cuve permettant de recevoir un électrolyte et d’électrodes qui se présentent sous forme de tiges ou de plaques, destinées d’une part à être en contact avec l’électrolyte et d’autre part à être connectées au circuit électrique externe.
Remarque : L’électrolyte est généralement une solution ionique qui assure la conduction électrique grâce aux ions qu’elle contient et qui peut fournir une partie ou la totalité des réactifs de la transformation forcée.
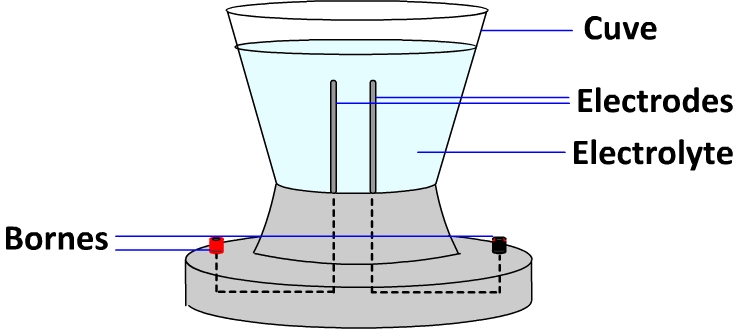
Dans le circuit électrique externe à l’électrolyseur, les électrons circulent de la borne négative vers la borne positive.
Au niveau de l’électrode reliée à la borne négative (appelée cathode), les électrons arrivent de la borne négative et sont fournis à l’un des réactifs, ce qui entraîne une réduction.
Au niveau de l’électrode reliée à la borne positive (appelée anode), les électrons sont prélevés à l’interface puis circulent en direction de la borne positive, entraînant une oxydation.
Quantité d’électrons échangés lors d’une électrolyse
Lors d’une électrolyse, le nombre d’électrons échangés peut être déterminé grâce aux demi-équations et relié aux quantités de matière mises en jeu.
Par exemple, lors de la transformation chimique entre les ions zinc Zn2+ et les ions iodure l’équation de réaction est:
2I– + Zn2+ → Zn + I2
Elle peut être décomposée en deux demi-équations :
- Zn2+ + 2e– → Zn
- 2I– → I2 + 2e–
On constate:
- qu’un ion Zn2+ est consommé pour deux électrons échangés
- un atome Zn est produit pour deux électrons échangés
- deux ions I– sont consommés pour deux électrons échangés
- une molécule de I2 est produite pour deux électrons échangés
Par ailleurs, l’intensité du courant électrique dans un circuit électrique est donnée par la relation :
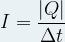
où :
- I est l’intensité du courant en Ampère (A)
- Q est la charge échangée en Coulomb (C)
- Δt est la durée de l’échange en seconde (s)
On peut ainsi en déduire l’expression de la charge échangé en fonction du temps :
|Q|= I x Δt
On peut aussi exprimer la charge électrique échangée par la relation :
|Q|= ne × NA × e
où
- ne est le nombre d’électrons échangés (en mol)
- NA est le nombre d’Avogadro (NA = 6,02 × 1023)
- e est la charge élémentaire (e = 1,6 × 10-19 C).
La constante de Faraday, notée F, est définie comme la charge d’une mole de charges élémentaires :
Par conséquent: F = NA × e= 96500 Coulomb par mol
La relation précédente peut donc aussi s’écrire :
|Q| = ne x F
A partir de ces deux expressions on peut obtenir une relation donnant le nombre d’électrons échangés :
|Q|= I x Δt et |Q| = ne x F
donc :
I x Δt = ne x F
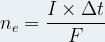
Variation de quantité de matière lors d’une électrolyse
Au niveau de la cathode il y a réduction d’une espèce chimique suivant la demi-équation de la forme suivante :
A1 + n1e– → A1’
La stoechiométrie de cette demi-équation indique que la quantité d’électrons échangés ne correspond à « n1 » fois la quantité de matière de produit formé n(A1’) :
ne = n1 x n(A1’)
or la quantité d’électrons circulant à travers une section du circuit électrique pendant une durée Δt est donnée par l’expression suivante :
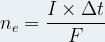
Par conséquent on peut exprimer la quantité de matière de produit formé au cours du temps :
n1 x n(A1’) = I x Δt
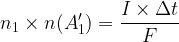
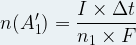
De même au niveau de l’anode où se produit l’oxydation décrite par la demi-équation suivante :
A2 →A2’ + n2e–
L’espèce chimique A2 est oxydée en cédant un nombre n2 d’électrons.
La quantité de matière n(A2’) du produit A2’ formé en une durée Δt lorsqu’un courant d’intensité « I » circule dans le circuit électrique est donnée par l’expression :
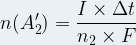
Stockage et conversion de l’énergie chimique
- Les piles
Les piles (dites piles électrochimiques) permettent de stocker de l’énergie sous forme chimique, elles comportent deux demi-piles constituées chacune des membres d’un couple oxydant-réducteur.
Une pile en fonctionnement est le siège d’une réaction d’oxydoréduction spontanée :
- son pôle négatif est le siège d’une oxydation qui libère des électrons circulant vers le circuit électrique.
- son pôle positif est le siège d’une réduction qui se fait en captant des électrons en provenance du circuit électrique externe.
La quantité d’énergie chimique disponible et le temps de fonctionnement d’une pile dépendent des quantités de réactifs qu’elle contient.
- Les accumulateurs
Les accumulateurs (aussi appelés « batteries ») convertissent de l’énergie chimique suivant le même principe que les piles : l’énergie chimique est convertie en énergie électrique grâce à une réaction d’oxydoréduction spontanée.
L’accumulateur est considéré comme déchargé lorsque l’un des réactifs est épuisé. En reliant cet accumulateur à un générateur électrique il est alors possible de provoquer une réaction d’oxydoréduction forcée qui permet de reformer les espèces chimiques initialement présentes : l’énergie électrique est convertie en énergie chimique.
- Les organismes chlorophylliens
Les organismes chlorophylliens sont le siège la photosynthèse, il s’agit d’un processus qui permet la production de matière organique grâce à l’énergie lumineuse captée et deux espèces chimiques de base : le dioxyde de carbone et l’eau.
La photosynthèse est une conversion d’énergie lumineuse en énergie électrique réalisée grâce à une réaction d’oxydoréduction forcée.
Les cours à réviser avant d’aborder cette leçon
Cours de terminale spécialité: Prévoir le sens d’évolution spontanée d’un système chimique
Cours de première spécialité: Réactions d’oxydoréduction et avancement
