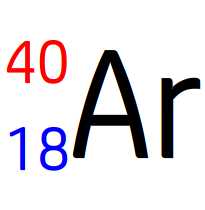Cours de chimie niveau seconde – Constitution et transformations de la matière – Partie 1: de l’échelle macroscopique à l’échelle microscopique – B) Modélisation de la matière à l’échelle microscopique – Le noyau de l’atome, siège de sa masse et de son identité
- Qu’est -ce que l’écriture conventionnelle d’un noyau ?
- Comment utiliser la composition d’un noyau pour trouver son écriture conventionnelle ?
- Comment utiliser l’écriture conventionnelle d’un noyau pour trouver sa composition ?
- Utiliser l’écriture conventionnelle pour trouver la composition d’un atome
- Utiliser l’écriture conventionnelle pour trouver la charge d’un noyau d’atome
- Utiliser l’écriture conventionnelle pour trouver la masse d’un noyau
- L’écriture conventionnelle d’un noyau dans le tableau périodique
- Quelques exemple d’écritures de conventionnelles de noyaux atomiques
Qu’est -ce que l’écriture conventionnelle d’un noyau ?
Tout les atomes, c’est à dire tous les isotopes de chaque élément chimique, disposent d’une écriture conventionnelle pour leur noyau: elle permet non seulement de les représenter (elle constitue un symbole du noyau) mais aussi de décrire leur composition.
L’écriture conventionnelle d’un noyau se note toujours de la manière suivante: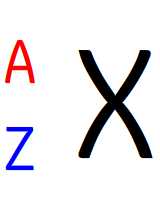
- X correspond au symbole chimique de l’élément ( C pour du carbone, H pour de l’hydrogène, Fe pour le fer etc.
- A (noté en haut à gauche du symbole chimique) est le nombre de masse.
- Z (noté en bas à droite du symbole chimique) est le numéro atomique.
Exemple
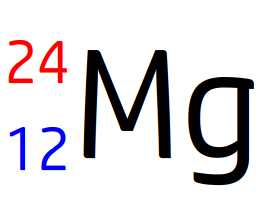
Cette écriture conventionnelle est celle du noyau de l’élément magnésium (symbole Mg) de numéro atomique Z = 12 et de nombre de masse 24.
Comment utiliser la composition d’un noyau pour trouver son écriture conventionnelle ?
Si l’on connaît la composition du noyau d’un atome, c’est à dire le nombre protons et le nombre de neutrons, alors il est possible d’établir la notation conventionnelle du noyau:
- le nombre de protons correspond au numéro atomique
- le symbole chimique de l’élément peut être déduit du numéro atomique (éventuellement avec une recherche dans le tableau périodique car chaque élément est caractérisé par son propre numéro atomique)
- Le nombre de masse A correspond à la somme du nombre de protons et du nombre de neutrons
Une fois ces trois informations réunies le symbole chimique est noté avec une taille suffisante, accompagné de la valeur de Z et A notés respectivement en bas à gauche et en haut à gauche.
Exemple
Un noyau atomique est composé de 6 protons et de 8 neutrons.
Ce noyau est celui d’un élément de numéro atomique Z=6 (puisqu’il a 6 protons)
Le tableau périodique indique que ce numéro atomique est celui du carbone de symbole C
Ce noyau comporte un total de 6 + 8 = 14 nucléons par conséquent son nombre de masse est A = 14
Il s’agit du noyau de l’isotope 14 de l’élément carbone
Son écriture conventionnelle est donc:
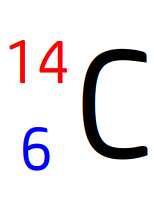
Comment utiliser l’écriture conventionnelle d’un noyau pour trouver sa composition ?
L’écriture conventionnel d’un noyau est souvent utilisée pour résumer sa composition, elle figure souvent parmi les données des exercices portant sur la composition des atomes.
Pour déduire la composition d’un noyau à partir de son écriture conventionnelle il suffit d’exploiter le numéro atomique et le nombre de masse qu’elle comporte:
- Le numéro atomique (Z) est le nombre noté en général en bas à gauche du symbole chimique (c’est toujours le plus petit des deux nombres de l’écriture conventionnelle). Par définition ce numéro atomique indique le nombre de protons du noyau.
- Le nombre de masse (A) est le nombre noté en haut à gauche du symbole chimique (c’est toujours le plus grand des deux nombres qui accompagnent le symbole chimique). Ce nombre de masse correspond par définition au nombre total de nucléons (protons + neutrons) qui constituent le noyau. On déduit le nombre de neutrons (N) par différence entre le nombre de nucléons et le nombre de protons, c’est à dire par différence entre le nombre de masse et le numéro atomique: N = A – Z.
Exemple
Voici l’écriture conventionnelle d’un noyau de plomb:
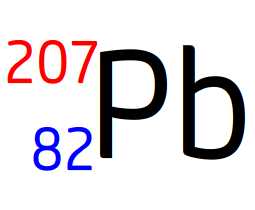
On en déduit:
- Le numéro atomique Z = 82
- Le nombre de masse A = 207
Ce noyau est donc composé:
Utiliser l’écriture conventionnelle pour trouver la composition d’un atome
Un atome est l’association d’un noyau et d’un cortège électronique constitué d’électrons, pour décrire sa composition il faut donc indiquer la composition du noyau et celle du cortège électronique.
La composition du noyau est déduite de l’écriture conventionnelle en suivant la méthode déjà décrite dans le paragraphe précédent (Comment utiliser l’écriture conventionnelle d’un noyau pour trouver sa composition ?)
Par ailleurs un atome est toujours électriquement neutre ce qui implique que le nombre de protons est égal au nombre d’électrons. Le nombre d’électrons correspond donc aussi au numéro atomique fourni par l’écriture conventionnelle.
Exemple
L’écriture conventionnelle d’un noyau de sélénium est la suivante:

On en déduit:
- Le numéro atomique Z = 34
- Le nombre de masse A = 79
Ce noyau de cet atome est donc composé:
Le cortège électronique est composé d’autant d’électrons que de protons c’est à dire de 34 électrons
Utiliser l’écriture conventionnelle pour trouver la charge d’un noyau d’atome
L’écriture conventionnelle comporte le numéro atomique du noyau et cette donnée permet de déduire sa charge électrique globale:
Z correspond au nombre de protons
Chaque proton possède une charge correspond à la charge élémentaire “e” (e = 1,6.10-19 C)
Le noyau possède donc une charge Q = Z x e
C’est à dire Q = Z x 1,6.10-19 C
Exemple
Un noyau de bore a pour écriture conventionnelle:
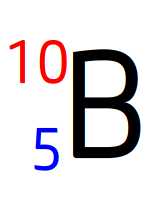
Son numéro atomique est donc Z = 5
Son noyau a une charge totale Q= 5 x e
C’est à dire Q = 5 x 1,6.10-19
Q = 8,0.10-19 C
Utiliser l’écriture conventionnelle pour trouver la masse d’un noyau
L’écriture conventionnelle d’un noyau inclut son nombre de masse qui peut être utilisé pour déterminer sa masse.
La masse d’un noyau (ou de l’atome ou de l’ion possédant ce noyau) peut être obtenue en multipliant le nombre du nucléons du noyau ( qui correspond au nombre de masse A) par la masse d’un nucléon (mn) par conséquent:
mnoyau = A x mn
L’écriture conventionnelle d’un noyau dans le tableau périodique
Le tableau périodique propose pour chaque élément une représentation qui s’apparente à une écriture conventionnelle car elle comprend toujours au minimum un symbole chimique, un numéro atomique est un nombre de masse (parfois aussi d’autres informations).
Cependant on remarque assez rapidement que le nombre de masse n’est pas un nombre entier mais un nombre décimal alors qu’un noyau ne peut comporter qu’un nombre entier de nucléons.
Ce nombre de masse n’est pas entier car il correspond à une moyenne des nombres de masses des isotopes qui constitue un échantillon naturel de l’élément
Par conséquent le tableau périodique ne fournit pas l’écriture conventionnelle d’un noyau déterminé mais une écriture conventionnelle “moyenne”.
Quelques exemple d’écritures de conventionnelles de noyaux atomiques
Voici l’écriture conventionnelle des noyaux atomiques correspondant aux isotopes majoritaires des éléments des trois premières périodes du tableau périodique:
Noyau d’hydrogène
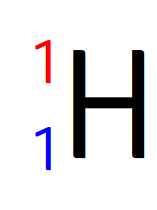
Noyau d’hélium

Noyau de lithium

Noyau de béryllium

Noyau de bore
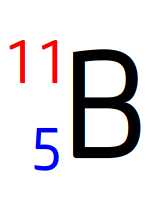
Noyau de carbone

Noyau d’azote

Noyau d’oxygène
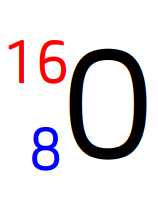
Noyau de fluor

Noyau de néon

Noyau de sodium

Noyau de magnésium
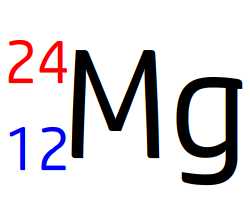
Noyau d’aluminium

Noyau de silicium

Noyau de phosphore

Noyau de soufre

Noyau de chlore

Noyau d’argon