- Le principe
- La réalisation expérimentale d’une échelle de teinte
Concentration des solutions de l’échelle de teinte
– Préparation de la solution mère
– Préparation des solutions fille - Utilisation de l’échelle de teinte pour estimer une concentration
- Exemple d’une échelle de teinte réalisée avec le permanganate
Le principe
Lorsqu’un soluté colore la solution dans laquelle il est dissous, la teinte de cette solution varie avec la concentration de ce soluté:
- plus la solution est concentrée et plus sa teinte est foncée
- moins la solution est concentrée et plus sa teinte est claire
Par conséquent il est possible de comparer la concentration de deux solutions en comparant leurs teinte. L’échelle de teinte exploitate le lien entre couleur et concentration, elle repose sur la préparation de d’une série de solutions S, S1, S2, S3 etc de concentrations décroissantes connues et de teintes de plus en plus claires. En comparant une solution de concentration inconnue à celle de l’échelle de teinte on peut ainsi obtenir un encadrement de cette concentration inconnue.
Une échelle de teinte a l’avantage:
- de permettre d’estimer rapidement la concentration d’une série de solutions
Mais elle a l’inconvénient:
- de ne fournir qu’un encadrement de la concentration
- de nécessiter un travail de préparation assez long
- de ne s’appliquer qu’aux espèces chimiques colorées comme par exemple l’ion permanganate ou l’ion cuivre.
La réalisation expérimentale d’une échelle de teinte
La solution mère
La solution est mère (S) est préparée en dissolvant une masse “m” de soluté dans le solvant. Elle constitue le premier niveau de l’échelle de teinte, celui ayant la concentration la plus élevée et la teinte la plus foncée. La masse m de soluté est a déterminer en fonction du volume de solution à préparer et de la concentration C souhaitée qui en générale est de l’ordre de 10-1 ou 10-2 mol/L.
Pour une concentration C et un volume V la masse m de soluté à peser est 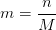
où n est la quantité de matière du soluté (en mol) et M la masse molaire du soluté
La masse molaire du soluté peut être déterminée à partir de la masse molaire des éléments qui le constitue.
La quantité de matière n est donnée par la relation suivante:
n = C.V
Une partie de la solution mère constitue le premier niveau de l’échelle de teinte tandis que le reste est utilisé pour réaliser une dilution et obtenir la première solution fille S1. Il faut donc en général prévoir un volume minimal de 50 mL de solution mère.
Le protocole pour préparer la solution mère S est le même que pour toute préparation de solution:
- Déterminer la masse m de soluté à dissoudre pour un volume V de solution coïncidant avec la contenance d’une fiole disponible (en général 50, 100 ou 200 mL)
- Effectuer la pesée avec une balance en ajoutant la masse m de soluté dans un bécher avec une spatule.
- Ajouter dans le bécher un volume d’eau distillée inférieur à celui de la solution prévue puis, sous agitation magnétique (avec barreau aimanté), dissoudre entièrement le soluté
- Verser le contenu du bécher dans une fiole dont la contenance coïncide avec le volume de la solution mère à préparer.
- Rincer le bécher avec de l’eau distillée et ajouter l’eau de rinçage dans la fiole
- Ajouter de l’eau distillée dans la fiole jusqu’au trait de jauge puis agiter (avec un bouchon pour homogénéiser le mélange).
Les solutions filles
- Les solutions filles constituent les niveaux suivants de l’échelle de teinte, elles sont obtenue par dilution successives à partir de la solution mère et possèdent des concentration de plus en plus faibles ainsi que des teintes de plus en plus claires. En général le facteur de dilution entre chacune d’entre elles varie de 2 à 10 (chaque dilution doit permettre d’obtenir une solution ayant une teinte distincte)
La première solution fille (S1) est obtenue par dilution de la solution mère (S), elle est réalisée : - en prélevant un volume V’ de solution mère (à l’aide d’une pipette jaugée pour plus de précision)
- en ajoutant ce prélèvement dans une fiole jaugée de volume V1
- en complétant par de l’eau distillée jusqu’au trait de jauge de la fiole
- en homogénéisant (par agitation avec bouchon)
La concentration de la solution fille ainsi obtenue est divisée par un facteur correspondant au rapport V1/V’
La deuxième solution fille (S2) est obtenue par dilution de la première solution fille (S1) en suivant un protocole similaire
La troisième solution fille (S3) est obtenue en diluant la seconde solution fille (S2)
etc
L’échelle de teinte peut comporter une nombre variable de solutions filles qui dépend de précision de l’encadrement souhaité.
Concentration des solutions de l’échelle de teinte
La solution mère S obtenue par dissolution d’une masse de soluté “m” (de masse molaire M) dans un volume de solution V a pour concentration:
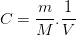
La solution fille S1 obtenue par dilution d’un volume V’ de solution mère dans une fiole volume V1 a pour concentration:
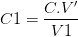
soit 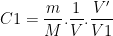
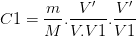
La solution fille S2 obtenue par dilution d’un volume V1′ de solution fille S1 dans une fiole volume V2 a pour concentration:
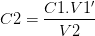
soit 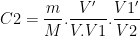
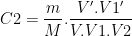
De même on pourrait montrer que:
la solution fille S3 a pour concentration 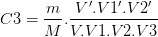
la solution fille S4 a pour concentration 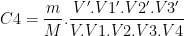
etc …
Utilisation de l’échelle de teinte pour estimer une concentration
La teinte de la solution est comparée à celles des solutions de l’échelle de teinte et les deux solutions qui s’en rapprochent le plus (celle qui est un peu plus foncée et celle qui est légerèrement plus claire) fournissent un encadrement de la concentration de la solution. Si par exemple la solution est plus claire que la solution fille S2 mais plus foncée que la solution fille S3 alors sa concentration est comprise entre celles de ces deux solution: C(S3) < C(solution) < C(S2)
Exemple: échelle de teinte pour l’ion permanganate
L’ion permanganate (MnO4–) colore les solutions aqueuses en rose-violet

Les 4 tubes à essais de gauches constituent l’échelle de teinte, de la teinte la plus foncée à la plus claire on peut voir et le tube de droite contient une solution de concentration inconnue en permanganate:
- 1) Solution mère S de concentration C(S)
- 2) Solution fille S1 de concentration C(S1)
- 3) Solution fille S2 de concentration C(S2)
- 4) Solution fille S3 de concentration C(S3)
- 5) Solution de concentration inconnue C(solution)
La teinte de la solution est intermédiaire entre celle de la solution fille S2 et celle de la solution fille S3 par conséquent C(S3) < C(solution) < C(S4)
