Constitution et transformations de la matière – 3. Prévoir l’état final d’un système, siège d’une transformation chimique- B) Comparer la force des acides et des bases
- Constante d’acidité « KA » d’un couple acide-base
- Constante d’acidité de l’eau
- pKA
- Diagramme de prédominance d’un couple acide-base
- Acides forts
- Bases fortes
- Les principales solutions acides et basiques
- Principe des indicateurs colorés
- Les acides alpha-aminés
- Solutions tampons
Constante d’acidité « KA » d’un couple acide-base
Définition
La constante d’acidité (notée KA) d’un couple acide-base correspond à la constante d’équilibre de la réaction entre l’acide de ce couple et l’eau.
Pour un couple acide-base de la forme AH/A– l’équation de réaction avec l’eau ( qui correspond à la base du couple acide-base H3O+/H2O ) est la suivante :
AH + H2O ⇌ A– + H3O+
La constante d’équilibre de cette réaction, et donc la constante d’acidité KA du couple AH/A–, a donc pour expression :
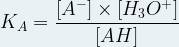
à condition d’exprimer les concentrations en mole par litre (mol.L-1)
Constante d’acidité de l’eau
La constante d’acidité de l’eau (aussi appelée produit ionique de l’eau) est notée Ke
Elle correspond à la constante d’acidité du couple acide-base (H2O/HO–) pour l’équilibre suivant :
H2O + H2O ⇌ OH– + H3O+
ou encore :
2H2O ⇌ OH– + H3O+
Par conséquent :
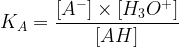
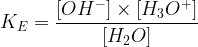
Etant donné que la concentration du solvant n’intervient pas dans l’expression d’une constante d’équilibre l’expression de la constante d’acidité de l’eau devient :
KE = [OH–].[H3O+]
à une température de 20°C sa valeur est :
Ke = 10-14
Cette constante fournit, pour toute solution aqueuse, une relation entre la concentration des ions oxonium et celle des ions hydroxyde.
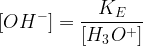
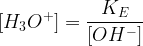
Le pKA
Le pKA d’un couple acide-base est défini comme l’opposé du logarithme décimal de la constante d’acidité de ce couple :
pKA = – Log (KA)
Le pKA est une caractéristique propre à chaque couple acide-base, c’est une grandeur qui permet de déterminer rapidement laquelle des deux formes d’un couple (l’acide ou la base) est majoritaire à un pH donné. (voir paragraphe suivant sur les diagrammes de prédominance)
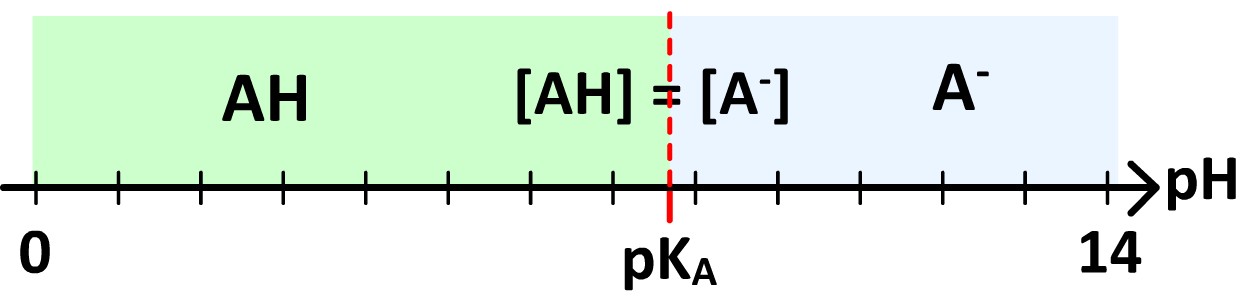
Diagramme de prédominance d’un couple acide-base
Le diagramme de prédominance acide-base d’un couple donné indique, selon le pH d’une solution aqueuse, laquelle des formes du couple est majoritaire par rapport à l’autre.
La relation qui définit le pKA est la suivante :
pKA = – Log (KA)
Si l’on remplace la constante d’acidité (KA) par son expression on obtient :
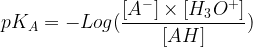
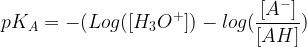
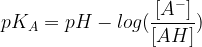
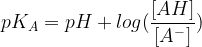
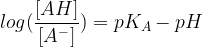
Un logaritme décimal est :
- positif si son argument est supérieur à 1 ( donc si le rapport [AH]/[A–] est supérieur à 1)
- négatif si son argument est inférieur à 1 ( donc si le rapport [AH]/[A–] est inférieur à 1)
Il en résulte que :
Si pH < pKA alors AH (la forme acide du couple) est majoritaire
Si pH > pKA alors A– (la forme basique du couple) est majoritaire
Si pH = pKA alors [AH] = [A–] (il s’agit du point équivalent)
Le diagramme de prédominance se présente sous la forme d’un axe de pH où est reporté le pKA du couple qui divise cet axe en deux :
- Le domaine où prédomine la forme acide du couple (lorsque le pH est inférieur au pKA)
- Le domaine où prédomine la forme basique du couple (lorsque le pH est supérieur au pKA)
Il est donc de la forme suivante :
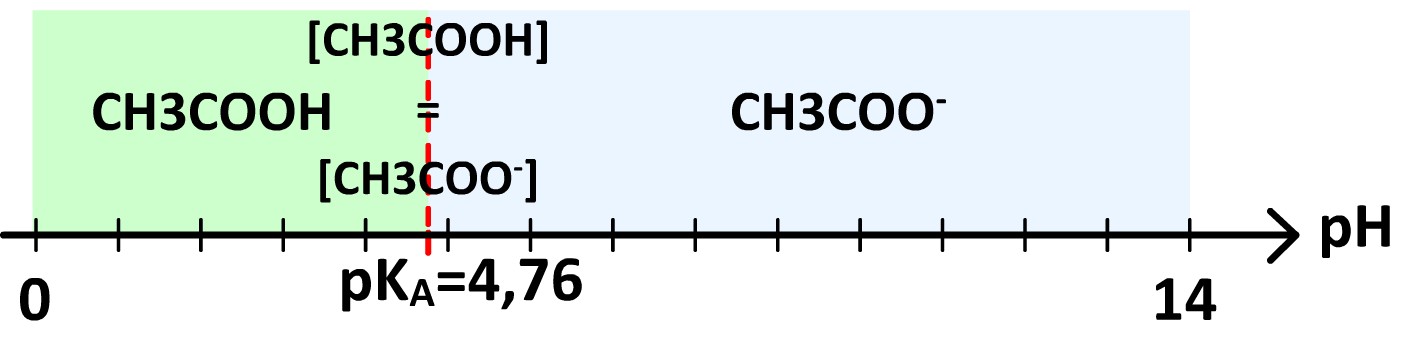
Exemple de l’acide acide éthanoïque
Le couple acide-base acide éthanoïque – éthanoate (CH3COOH/CH3COO–)
Le pKA de ce couple 4,76 Par conséquent :
- Si pH < 4,76 [CH3COOH] > [CH3COO–]
- Si pH = 4,76 [CH3COOH] = [CH3COO–]
- Si pH > 4,76 [CH3COOH] < [CH3COO–]
Acides forts
Définition d’un acide fort
Un acide est dit fort si sa réaction avec l’eau est totale quel que soit le pH initial de cette solution : la totalité de cet acide se transforme en sa base conjuguée.
Un acide fort appartient à un couple dont le pKA est inférieur à -1 (inférieur d’une unité à celui du couple H3O+/ H2O )
Si l’acide du couple AH/A– est un acide fort alors la réaction suivante est totale :
AH + H2O → A– + H3O+
Par conséquent, si l’on dissout un acide fort dans de l’eau avec une concentration initiale C0 alors après dissolution :
Bases fortes
Définition d’une base forte
Un base est dite forte si sa réaction avec l’eau est totale quel que soit le pH initial de cette solution : la totalité de cette base se transforme en son acide conjugué.
Un base forte appartient à un couple dont le pKA est supérieur à 15 ( supérieur d’une unité à celui du couple H2O/HO–)
Si la base du couple AH/A– est une base forte alors la réaction suivante est totale :
A– + H2O → AH + HO–
Par conséquent si l’on dissout une base forte dans de l’eau avec une concentration initiale C0 alors après dissolution :
Les principales solutions acides et basique
L’acide chlorhydrique
- L’acide Chlorhydrique a pour formule HCl
- Sa base conjuguée est l’ion chlorure (Cl–)
- Il appartient au couple (HCl / Cl– )
- C’est un acide fort
En solution aqueuse il réagit totalement avec l’eau, une solution aqueuse d’acide chlorhydrique est donc essentiellement constituée d’eau, d’ions chlorures et d’ions oxonium.
L’acide nitrique
- L’acide nitrique a pour formule HNO3
- Sa base conjuguée est l’ion nitrate (NO3–)
- Il appartient au couple ( HNO3 / NO3–)
- C’est un acide fort
En solution aqueuse il réagit totalement avec l’eau, une solution aqueuse d’acide nitrique donc essentiellement constituée d’eau, d’ions nitrates et d’ions oxonium.
L’acide éthanoïque
- L’acide éthanoïque a pour formule CH3COOH
- Sa base conjuguée est l’ion éthanoate (CH3COO–)
- Il appartient au couple ( CH3COOH / CH3COO–)
- C’est un acide faible de pKA = 4,76
Une solution aqueuse d’acide éthanoïque est un mélange essentiellement constitué d’eau, d’acide éthanoïque, d’ions éthanoate et d’ions oxonium.
L’hydroxyde de sodium (soude)
- L’hydroxyde de sodium est un composé ionique de formule NaOH
- En solution aqueuse il se dissocie totalement en ion sodium (Na+) et en ion Hydroxyde (HO–)
L’ammoniac
- L’ammoniac est une base de formule NH3
- Son acide conjugué est l’ion ammonium (NH4+)
- Il appartient au couple ( NH4+ / NH3)
- C’est une base faible de pKA 9,25
Une solution aqueuse d’ammoniac est un mélange essentiellement constitué d’eau, d’ammoniac, d’ions ammonium et d’ions hydroxyde.
Principe des indicateurs colorés
Définition
Un indicateur coloré correspond à un couple acide-base dont les deux membres ont une couleur différente.
Par conséquent un indicateur colorée donne à la solution où il est dissout une couleur qui dépend du pH :
- Si pH < pKA (plus précisément si pH< pKA – 1) alors la forme acide prédomine et impose sa couleur
- Si pH > pKA (plus précisément si pH> pKA + 1) alors la forme basique prédomine et impose sa couleur
- Si le pH est proche du pKA ( plus précisément si pKA – 1 < pH < pKA + 1) alors les deux formes coexistent et la solution prend une couleur qui résulte de la combinaison des couleurs des deux formes), on dit la solution prend une « teinte sensible »
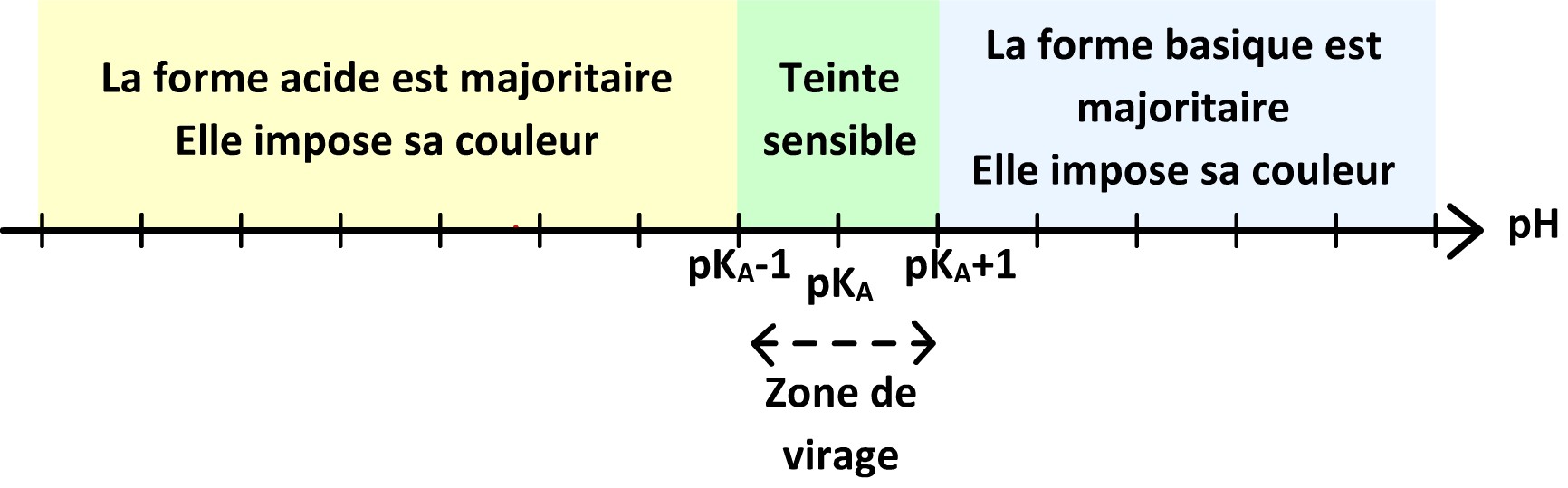
Un indicateur coloré peut être utilisé lors d’un dosage acide-base : il permet de repérer le point équivalent à condition que sa zone de virage (intervalle de pH correspondant à la teinte sensible) est comprise dans le saut de pH se produisant autour du volume équivalent.
Les acides alpha aminés
Un acide alpha-aminé est une espèce chimique organique comportant à la fois une fonction acide carboxylique (-COOH) et une fonction amine (-NH2).
Ces deux fonctions sont portées par le même carbone, un acide alpha aminé possède donc une structure de la forme suivante :
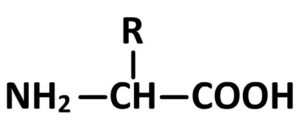
(où R est un groupement carboné)
La fonction acide carboxylique est une fonction acide dont le couple est caractérisé par son pkA (pKA1)
Par conséquent :
- la forme acide -COOH prédomine si pH < pKA1
- La forme basique acétate -COO– prédomine si pH > pKA1
La fonction amine est une fonction basique dont le couple est caractérisé par son pKA (pkA2), avec pkA2 > pkA1Par conséquent :
- La forme acide ammonium -NH3+ prédomine si pH < pKA2
- La forme basique -NH2 prédomine si pH > pKA2
Si l’on tient compte de ces deux fonctions :
- Si pH < pKA1 alors l’acide aminé est de forme :
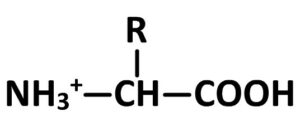
- Si pH > pKA2 alors l’acide aminé est de forme :
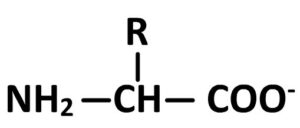
- Si pkA1 < pH < pKA2 alors l’acide aminé est de forme :
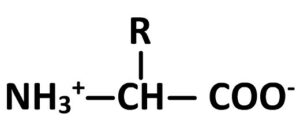
Cette dernière forme, bien que globalement neutre, présente une charge négative et une charge positive portée par deux sites différents.
Ce type de structure est désignée sous le nom de Zwitterion
Définition
Un zwitterion une espèce chimique globalement neutre mais qui porte des charges électriques positives et négatives sur des sites différents.
Solutions tampons
- Définition
Une solution est dite tampon si l’ajout modéré d’acide ou de base ne provoque qu’une faible variation de pH.
- Composition d’une solution tampon
Une solution tampon est en général composée d’un mélange d’un acide et de sa base conjuguée à des concentrations très proches
Un mélange en solution aqueuse d’un acide faible AH et sa base conjugué A– tel que [AH] = [A–] constitue une solution tampon.
- Préparation d’une solution tampon
Une solution tampon peut-être obtenue :
- par addition d’une base forte à un acide faible jusqu’au point de demi-équivalence
- Elle peut aussi être obtenue par addition d’un acide fort à une base faible jusqu’au point de demi-équivalence.
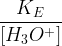 =
= 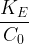
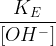 =
=