Cours de chimie niveau seconde – Constitution et transformations de la matière – Partie 1: de l’échelle macroscopique à l’échelle microscopique – B) Modélisation de la matière à l’échelle microscopique – Le cortège électronique de l’atome définit ses propriétés chimiques.
- Qu’est-ce que le bloc s ?
- Repérer le bloc s dans le tableau périodique
- Liste des éléments du bloc s
- Qu’est-ce que le bloc p ?
- Repérer le bloc p dans le tableau périodique
- Liste des éléments du bloc p
- Comment savoir si un élément appartient au bloc s ou au bloc p
- Les autres blocs du tableau périodique
Qu’est-ce que le bloc s ?
Il s’agit d’un
groupe d’élements du tableau périodique: dans leur état
fondamental ces éléments on tous comme dernière sous-couche
occupée une sous-couche s.
Si la dernière
sous-couche notée dans la configuration électronique d’un élément
est une sous-couche s alors il s’agit d’un élément du bloc s
Exemple
Le sodium (Z=11) a
pour configuration électronique 1s22s22p63s1
, la dernière sous-couche occuppée est 3s par conséquent
cet élément appartient bien au bloc s.
Repérer le bloc s dans le tableau périodique
Le bloc s est constitué des deux premières colonnes du tableau périodique, il comprend donc la famille des alcalins (première colonne) et la famille des alcalino-terreux.
L’hélium, qui se trouve dans la dernière colonne est une exception, il est aussi ratâché au bloc s puisque sa configuration électronique est 1s2.
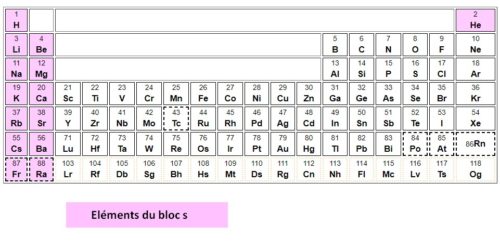
Liste des éléments du bloc s
| Numéro atomique | Symbole | Nom |
| Z=1 | H | Hydrogène |
| Z=2 | He | Hélium |
| Z=3 | Li | Lithium |
| Z=4 | Be | Béryllium |
| Z=11 | Na | Sodium |
| Z=12 | Mg | Magnésium |
| Z=19 | K | Potassium |
| Z=20 | Ca | Calcium |
| Z=37 | Rb | Rubidium |
| Z=38 | Sr | Strontium |
| Z=55 | Cs | Césium |
| Z=56 | Ba | Baryum |
| Z=87 | Fr | Francium |
| Z=88 | Ra | Radium |
Qu’est-ce que le bloc p ?
Le bloc p est le
groupe d’éléments du tableau périodique qui, dans leur état
fondamental, ont comme dernière sous-couche occuppée par des
électrons une sous-couche p.
La configuration
électronique d’un élément du groupe p se termine donc toujours
par une sous-couche p
Repérer le bloc p dans le tableau périodique
Le bloc p est constitué des six dernières colonnes du tableau périodique à l’exception de l’hélium (rattaché au bloc s)
Il comprend:
- la famille des gaz nobles
- la famille des halogènes
- la famille de l’oxygène
- la famille de l’azote
- la famille du carbone
- la famille du bore
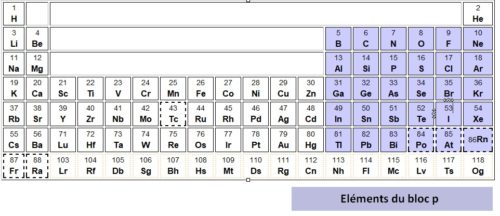
Liste des éléments du bloc p
| Numéro atomique | Symbole | Nom |
| Z=5 | B | Bore |
| Z=6 | C | Carbone |
| Z=7 | N | Azote |
| Z=8 | O | Oxygène |
| Z=9 | F | Fluor |
| Z=10 | Ne | Néon |
| Z=13 | Al | Aluminium |
| Z=14 | Si | Silicium |
| Z=15 | P | Phosphore |
| Z=16 | S | Soufre |
| Z=17 | Cl | Chlore |
| Z=18 | Ar | Argon |
| Z=31 | Ga | Gallium |
| Z=32 | Ge | Germanium |
| Z=33 | As | Arsenic |
| Z=34 | Se | Sélénium |
| Z=35 | Br | Brome |
| Z=36 | Kr | Krypton |
| Z=49 | In | Indium |
| Z=50 | Sn | Étain |
| Z=51 | Sb | Antimoine |
| Z=52 | Te | Tellure |
| Z=53 | I | Iode |
| Z=54 | Xe | Xénon |
| Z=81 | Tl | Thallium |
| Z=82 | Pb | Plomb |
| Z=83 | Bi | Bismuth |
| Z=84 | Po | Polonium |
| Z=85 | At | Astate |
| Z=86 | Rn | Radon |
| Z=113 | Nh | Nihonium |
| Z=114 | Fl | Flérovium |
| Z=115 | Mc | Moscovium |
| Z=116 | Lv | Livermorium |
| Z=117 | Ts | Tennesse |
| Z=118 | Og | Oganesson |
Comment savoir si un élément appartient au bloc s ou au bloc p
Pour déterminer le bloc auquel appartient un élément on peut :
- soit repérer la position de cet élément dans le tableau périodique.
- soit déterminer sa configuration électronique.
Position dans le tableau périodique:
- Si l’élément est dans l’une des deux premières colonnes du tableau ou dans sa première période alors il fait partie du bloc s
- Si l’élément est situé parmi les six dernières colonne du tableau (à l’exception de l’hélium) alors il fait partie du bloc p.
- S’il l’élément n’est dans aucune des deux situations précédentes alors il n’appartient ni au bloc s ni au bloc p mais à un autre bloc du tableau (bloc d ou f).
Configuration électronique:
- Après avoir trouvé la configuration électronique il suffit de repérer la dernière sous-couche notée.
- Si la dernière sous-couche est une sous-couche s alors l’élément fait partie du bloc s
- Si la dernière sous-couche est une sous-couche p alors l’élément fait partie du bloc p
- Dans tout autre cas l’élément fait partie d’un autre bloc.
Les autres blocs du tableau périodique
Les bloc s et p ne sont pas les seuls du tableau périodique, il en existe deux autres:
- le bloc d situé entre le bloc s et le bloc p, c’est à dire de la colonne 3 à la colonne 12.
- le bloc f constitué des deux périodes notées sous les autres blocs du tableau (il comporte la famille des lanthanides et de actinides
