Cours de chimie niveau seconde –2. Modélisation des transformations de la matière et transfert d’énergie– B) Transformations physiques
- Qu’est-ce qu’un changement d’état ?
- Les principaux changements d’état
- La fusion
- La vaporisation
- La solidification
- La liquéfaction
- La sublimation
- La condensation
- Description microscopique des changements d’état
- Equation de changement d’état
- Changements d’états exothermiques et endothermiques
Qu’est-ce qu’un changement d’état ?
Un changement d’état est une transformation physique au cours laquelle l’état physique d’un corps change.
Au cours d’un changement d’état les différentes espèces chimiques sont conservées (en nature et en quantité) mais les entités chimiques subissent des modification au niveau de leur organisation: leur liberté de se mouvoir est modifiée.
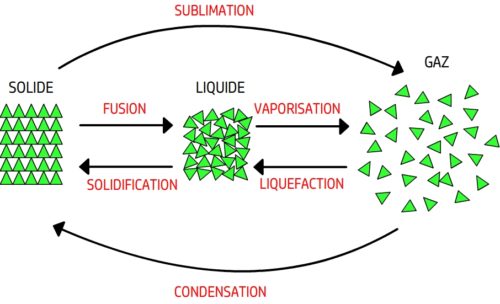
Les principaux changements d’état
Les principaux changements d’état sont:
- La fusion
- La vaporisation
- La solidification
- La liquéfaction
- La sublimation
- La condensation
Remarque
La matière peut présenter, dans des situations particulières, des formes qualifiées d’état, on peut par exemple citer:
- Le plasma
- Le plasma de quarks-gluons (quagma)
- Le gaz de fermions dégénérés
- Le condensat de Bose-Einstein
On pourrait donc considérer d’autres changements d’état comme le passage de l’état gazeux à l’état plasmatique mais ils n’obéissent pas à toutes les règles des changements d’état classiques et ne sont pas au programme de la classe de seconde.
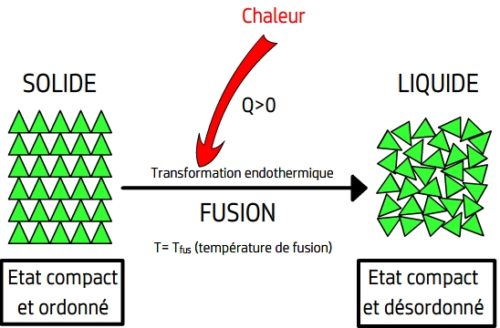
La fusion
Définition
La fusion est passage de l’état solide à l’état liquide.
La fusion d’un corps pur solide se produit lorsque sa température atteint une limite appelée température de fusion.
Lors d’une fusion l’énergie thermique reçue par le solide permet à ses entités chimiques de vaincre les forces d’attraction qui les maintiennent fixes les unes par rapports aux autres. Cette énergie thermique accroit l’agitation thermique des entités chimiques qui ne restent plus fixes mais peuvent se déplacer tout en restant au contact les unes des autres.
La fusion est un phénomène endothermique: la matière qui subit une fusion reçoit de l’énergie thermique de la part du milieu extérieur.
La fusion peut être représentée par une équation de changement d’état de la forme:
Espèce chimique (s) → Espèce chimique (l)
Exemples
- Fusion de la glace : H2O(s) → H2O(l)
- Fusion du fer: Fe(s) → Fe(l)
- Fusion de l’or : Au(s) → Au(l)
La fusion est le changement d’état inverse de la solidification.
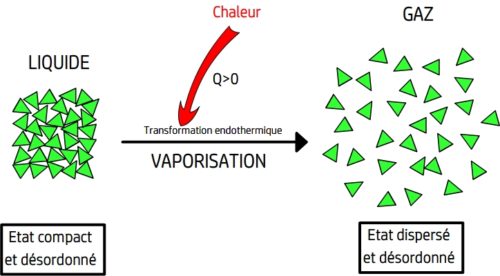
La vaporisation
Définition
La vaporisation est le passage de l’état liquide à l’état gazeux
La vaporisation peut se produire soit par évaporation (progressivement) soit par ébullition (transformation complète).
L’ébullition se produit lorsqu’un corps liquide atteint sa température d’ébullition.
Lors d’une ébullition les entités chimiques du corps liquide reçoivent une énergie thermique qui leur permet de vaincre les forces attractives les maintenant au contact les unes des autres. L’agitation thermique des entités chimiques est alors suffisante pour qu’elles puissent se déplacer librement sans contatc avec les autres entités.
L’ébullition est une transformation physique endothermique, elle se réalise lorsqu’un liquide absorbe l’énergie thermique du milieu extérieur.
La vaporisation peut être représentée par l’équation de changement d’état ayant la forme suivante:
Espèce chimique (l) → Espèce chimique (g)
Exemples
- Vaporisation de l’eau liquide: H2O((l) → H2O(g)
- Vaporisation de l’éthanol: C2H6O(l) → C2H6O(g)
La vaporisation est le changement d’état inverse de la liquéfaction
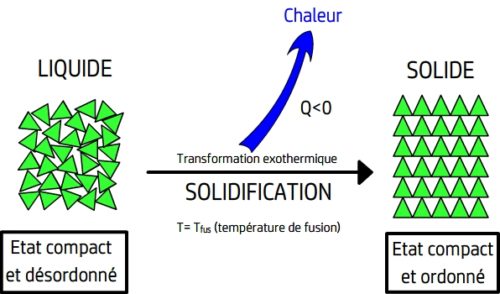
La solidification
Définition
La solidification est le passage de l’état liquide à l’état solide
La solidification d’un liquide se produit lorsqu’un liquide se refroidit assez sa température de solidfication (qui a même valeur que la température de fusion de ce corps pur)
Lors d’une solidification l’agitation des entités chimiques du liquide diminue et ces dernières perdent leur capacité à se déplacer les unes par rapport aux autres, Les entités chimiques se “figent” et ne gardent que la possibilité de “vibrer” autour d’une position fixe.
La solidification est une transformation physique exothermique, elle cède de l’énergie thermique au milieu extérieur dont la température augmente.
La solidification peut être représentée par une équation de changement d’état du type:
Espèce chimique (l) → Espèce chimique (s)
Exemples
- Solidification de l’eau: H2O(l) → H2O(s)
- Solidification du plomb: Pb(l) → Pb(s)
La solidification est le changement d’état inverse de la fusion
La liquéfaction
Définition
La liquéfaction est le passage de l’état gazeux à l’état liquide
La liquéfaction se produit lorsque la température d’un gaz diminue suffisamment pour atteindre sa température de liquéfaction (qui a même valeur que la température d’ébullition de ce corps pur)
Lors d’une liquéfaction l’agitation des entités chimiques diminue et celles-ci perdent leur capacité de se mouvoir de manière indépendante, les forces d’attraction entre entités les contraignent à se raprocher puis à rester au contact les unes des autres. Les entités chimiques peuvent toujours se déplacer mais perdent une partie de leur liberté, elles restent nécessairement au contact des autres entités chimiques.
Une liquéfaction est une transformation physique exothermique au cours de laquelle le gaz cède l’énergie thermique au milieu extérieur.
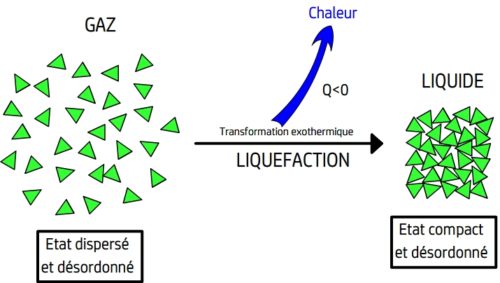
Un liquéfaction peut être représentée par une équation de changement d’état du type:
Espèce chimique (g) → Espèce chimique (l)
Exemples
- liquéfaction de l’eau: H2O(g) → H2O(l)
- liquéfaction de l’ammoniac: NH3(g) → NH3(l)
La liquéfaction est le changement inverse de la vaporisation
La sublimation
Définition
La sublimation est le passage direct d’un état solide à un état gazeux
Lors d’une sublimation l’agitation des entités chimiques s’accroit brutalement celles-ci peuvent alors se déplacer librement sans contrainte de contact.
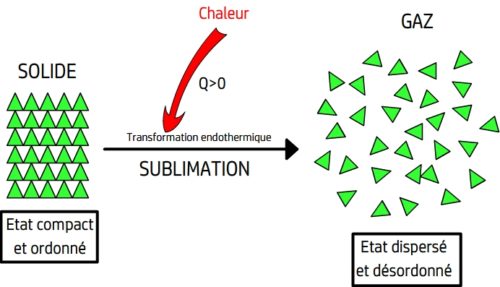
La sublimation peut être représentée par une équation de changement d’état du type:
Espèce chimique (s) → Espèce chimique (g)
Exemple
Sublimation de la glace: H2O(s) → H2O(g)
La sublimation est une transformation physique endothermique, elle se fait en recevant de l’énergie thermique du milieu extérieur.
Le changement d’état inverse de la sublimation est le condensation
La condensation
Définition
La condensation est la passage direct de l’état gazeux à l’état solide
La condensation se produit lors du brutal abaissement de température d’un gaz, l’agitation des entités chimiques baissent au point de perdre toute possibilité de déplacement, elles se fixent les unes par rapport aux autres.
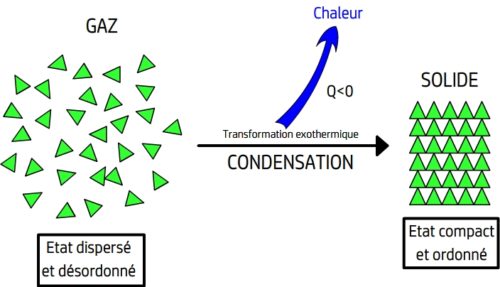
La condensation peut être représentée par une équation de changement d’état du type:
Espèce chimique (g) → Espèce chimique (s)
Exemple
Condensation de la vapeur d’eau: H2O(g) → H2O(l)
Une condensation est une transformation exothermique, de l’énergie thermique est cédée au milieu extérieur.
La condensation est le changement d’’état inverse de la sublimation.
Description microscopique des changements d’état
Les changements d’états se caractérisent par une modification de l’organisation des entités chimiques qui constituent la matière et en particulier il y a une modification de la capacités des entités chimiques à se déplacer.
Plus l’état est associé à une température elevée et plus la liberté de se déplacer de entités est grande.
Inversemement, plus l’état est associé à une température basse et moins les entités ont de liberté pour se déplacer:
- L’état solide est celui ou la liberté des entités chimiques est minimale: elles peuvent seulement vibrer c’est à dire osciller autour d’une position d’équilibre fixe (en théorie lorsque le zéro absolue est atteint, à environ -273°C ces entités deviennent parfaitement immobiles et ne vibrent même plus)
- L’état gazeux est celui ou la liberté des entité chimiques est maximale: elles peuvent se déplacer librement les unes par rapports aux autres.
- L’état liquide est un état intermédiaire où les entités chimiques dispose d’une liberté de se déplacer mais avec la contrainte de rester en contact les unes avec les autres.
Lors d’une élévation de température l’agitation des entités augemente progressivement et chaque changement d’état (fusion, vaporsation) constitue le franchissement d’une limite qui permet de gagner une liberté de mouvement supplémentaire.
Inversement, lors d’une diminution de température l’agitation des entités diminue progressivement et chaque changement d’état (liquéfaction, solidification) correspond au franchissement d’une limite où la liberté de mouvement diminue.
Equation de changement d’état
Tout comme une transformation chimique, un changement d’état peut être symboliquement représenté par une équation.
Cette équation respecte certains codes déjà connus:
- L’état initial est noté à gauche
- L’état finial est noté à droite
- Une fléche symbolise le passage de l’état initial à l’état final.
- L’espèce chimique qui change d’état est representé pas sa formule chimique.
Par ailleurs on précise l’état physique de l’espèce chimique entre parenthèse après sa formule chimique:
Un changement d’état est une transformation physique et les espèces chimiques se conservent par conséquent:
- Il y a une seule formule chimique identique à gauche et à droit de la flèche.
- Il n’est pas nécessaire d’équilibrer (ouf !) et de rajouter des coefficients stoechiométriques.
Par conséquent les équations de changement d’état auront toujours la forme suivante:
- Fusion: Espèce chimique (s) → Espèce chimique (l)
- Vaporisation: Espèce chimique (l) → Espèce chimique (g)
- Liquéfaction: Espèce chimique (g) → Espèce chimique (l)
- Solidification: Espèce chimique (l) → Espèce chimique (s)
- Sublimation; Espèce chimique (s) → Espèce chimique (g)
- Condensation; Espèce chimique (g) → Espèce chimique (s)
Changements d’états exothermiques et endothermiques
Un changement d’état ne peut avoir lieu sans un échange d’énergie thermique avec le milieu extérieur.
Définitions
- Un changement d’état est dit exothermique si de l’énergie thermique est cédée au milieu extérieur.
- Un changement d’état est dit endothermique si de l’énergie thermique est reçue par le corps qui change d’état.
La fusion, l’ébullition et la sublimation sont des changement d’état endothermiques
La solidification, la liquéfaction et la condensation sont exothermiques
