Cours de chimie niveau seconde – Constitution et transformations de la matière – Partie 1: de l’échelle macroscopique à l’échelle microscopique – B) Modélisation de la matière à l’échelle microscopique
Voir cours “L’atome“
1) Les constituants de l’atome
L’atome est une particule constituée de particules encore plus petites:
- son noyau au centre
- les électrons qui tournent autour du noyau et forment le cortège électronique (aussi appelé nuage électronique)
Le noyau est la partie la plus massive et la plus grande de l’atome, il est constitué de particules appelées nucléons.
Il existe deux sortes de nucléons:
Les électrons sont des particules mobiles négatives qui tournent autour du noyau dont ils sont séparés par du vide.
Voir cours “L’atome“, “Les protons“, “Les neutrons“, “Les électrons“
2) Ecriture conventionnelle du noyau
Le noyau d’un atome peut être représenté par son écriture conventionnelle qui prend toujours la forme suivante:
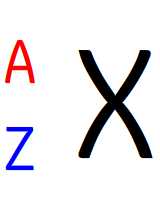
- Z est le numéro atomique du noyau, il correspond au nombre de protons dans ce noyau.
- A est le nombre de masse qui correspond au nombre de nucléons du noyau.
- X est le symbole atomique.
Cette écriture permet de décrire la composition de l’atome:
- Z indique le nombre de protons mais aussi le nombre d’électrons car un atome est neutre et possède toujours autant de protons que d’électrons.
- Le nombre de neutrons (N) peut être déduit de A et de Z: N = A – Z
Voir cours “Le numéro atomique“, “Ecriture conventionnelle d’un noyau“
3) Taille de l’atome et du noyau
On retient que:
- la taille (diamètre) d’un atome est de l’ordre de 10-10 m
- la taille (diamètre) du noyau atomique est de l’ordre de 10-15 m
Le noyau d’un atome est environ 100 000 fois plus petit que l’atome lui-même.
Il y a très peu de matière dans un atome qui est essentiellement composé de vide.
Voir cours “Taille d’un atome“
4) Masse de l’atome et de son noyau
La masse d’un atome est concentrée dans son noyau.
Les protons et les neutrons ont une masse proche, on peut considérer qu’un nucléon a une masse de l’ordre mn = 1,67.10-27 kg
Un électron a une masse de me= 9,1.10-31 kg
Un électron a une masse près de 2000 fois plus faible que celle d’un nucléon par conséquent la masse du cortège électronique est négligeable par rapport à celle du noyau.
Pour calculer la masse d’un noyau atomique il suffit de multiplier le nombre de nucléons (A) par la masse d’un nucléon (mn):
mNoyau= A x mn
On peut faire l’approximation que la masse d’un atome correspond à celle de son noyau:
mAtome ≈ mNoyau= A x mn
Voir cours “La masse d’un atome“
5) Charge électrique
La charge électrique est une caractéristique de la matière qui se note Q (parfois “q”).
Son unité est le Coulomb (C), elle peut être soit positive soit négative.
La plus petite charge électrique présente dans la matière est appelée “charge électrique élémentaire”, elle se note “e” et vaut :
- e = 1,6.10-19 C
Chaque proton possède une charge électrique élémentaire positive :
- Qproton = e = 1,6.10-19 C
La charge du noyau est donc:
- Qnoyau = Z x e
Chaque électron possède une charge électrique élémentaire négative:
- Qélectron = -e = -1,6.10-19 C
La charge du cortège électronique d’un atome est donc:
- Qcortège = Z x (-e) = – Zxe
Un atome est toujours globalement neutre, sa charge totale est nulle:
- Qatome = 0
Voir cours “La charge électrique“
6) Neutralité électrique de l’atome
Un atome est toujours globalement électriquement neutre, c’est à dire que sa charge totale est nulle:
La charge négative du cortège électronique est compensée par la charge positive du noyau.
La conséquence de cette neutralité est que le nombre de protons dans le noyau est égal au nombre d’électrons dans le cortège électronique.
7) Notion d’élément chimique
Le terme “élément chimique” désigne l’ensemble des particules monoatomiques caractérisées par le même numéro atomique Z. Des particules qui correspondent au même élément chimique sont donc celles qui ont le même nombre de protons dans leur noyaux.
Par exemple toutes les particules caractérisées par Z = 8 (8 protons dans le noyau) correspondent à l’élément oxygène.
Des particules monoatomiques ayant le même nombre de protons mais avec un nombre de neutrons différents sont des isotopes.
Voir cours “Les éléments chimiques“
Les autres cours de physique-chimie niveau seconde
- Corps purs et mélanges au quotidien
- Les solutions aqueuses, un exemple de mélange
- Du macroscopique au microscopique, de l’espèce chimique à l’entité
- Le noyau de l’atome, siège de sa masse et de son identité
- Le cortège électronique de l’atome définit ses propriétés chimiques
- Vers des entités plus stables chimiquement
- Transformation physique
- Transformation chimique
- Transformation nucléaire
- Décrire un mouvement
- Modéliser une action sur un système
- Principe d’inertie
- Emission et perception d’un son
- Vision et image
- Circuits électriques
- Capteurs
