Cours de chimie niveau seconde –2. Modélisation des transformations de la matière et transfert d’énergie– C) Transformation nucléaire
- Les isotopes
- Notation des noyaux et des particules libres
- Propriétés des transformations nucléaires
- Equation de transformation nucléaire
- Fission nucléaire
- Fusion nucléaire
- Energie libérée par les transformations nucléaires
Voir aussi la version vidéo de ce cours de physique-chimie
Les isotopes
Tout élément chimique est caractérisé par son numéro atomique “Z” qui correspond au nombre de protons dans son noyau.
Les noyaux correspondant à un même élément chimique ont par conséquent tous le même nombre de protons par contre ils n’ont par nécessairement le même nombre de neutrons.
Définition
Deux noyaux (ou particules monoatomiques) sont des isotopes l’un de l’autre s’ils ont le même nombre de protons mais que leur nombre de neutrons est différent.
Par conséquent deux noyaux peuvent être qualifiés d’isotopes si:
- Ils ont le même nombre de protons mais pas le même nombre de neutrons
- Ils ont le même nombre de protons mais pas le même nombre de nucléons
- Ils ont le même numéro atomique (Z) et pas le même nombre de masse (A)
- Ils correspondent au même élément chimique mais ont des noyaux différents
Exemple
Le noyau ![]() et le noyau
et le noyau ![]() sont isotopes car ils ont le même numéro atomique (Z = 6 ) mais pas le même nombre de nucléons ( A = 12 pour le premier et A = 14 pour le second)
sont isotopes car ils ont le même numéro atomique (Z = 6 ) mais pas le même nombre de nucléons ( A = 12 pour le premier et A = 14 pour le second)
Définition
Les isotopes d’un élément correspondent aux différents noyaux caractérisés par le numéro atomique propre à cet élément.
Exemple
On peut dire que ![]() est un isotope de l’élément carbone. Ce noyau possède 6 protons (Z=6) comme tous les noyaux de carbone.
est un isotope de l’élément carbone. Ce noyau possède 6 protons (Z=6) comme tous les noyaux de carbone.
Pour nommer un isotope on utilise le nom de l’élément chimique suivi du nombre de masse
Exemple
- L’isotope du carbone comportant 14 nucléons (
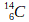 ) est appelé carbone 14
) est appelé carbone 14 - L’isotope du carbone comportant 12 nucléons (
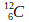 ) est appelé carbone 12
) est appelé carbone 12
Notation des noyaux et des particules libres
Lors de l’étude des transformations nucléaires la notation d’un noyau ou d’une particule libre (n’appartenant pas à un noyau) est de forme: ![]()
Cette notation est identique à celle des éléments chimiques du tableau périodique avec cependant une petite différence au niveau de Z:
- A correspond toujours au nombre total de nucléons
- Z ne représente plus le nombre de protons mais le nombre de charges élémentaires portées par le noyau ou la particule (il est positif pour une charge positive et négatif pour une charge négative)
Exemples
L’un des isotopes du carbone a pour symbole ![]() , ce qui signifie qu’il comporte un total de 12 nucléons ainsi que 6 charges élémentaires positives.
, ce qui signifie qu’il comporte un total de 12 nucléons ainsi que 6 charges élémentaires positives.
La particule de symbole ![]() est composée d’un seul nucléon et porte une charge élémentaire positive: il s’agit d’un proton.
est composée d’un seul nucléon et porte une charge élémentaire positive: il s’agit d’un proton.
La particule de symbole ![]() est composée d’un seul nucléon et ne porte aucune charge électrique: il s’agit d’un neutron.
est composée d’un seul nucléon et ne porte aucune charge électrique: il s’agit d’un neutron.
Symbole des principales particules
Propriétés des transformations nucléaires
Définition
Une transformation est dite nucléaire si elle affecte les noyaux atomiques. Les nucléons qui composent les noyaux des réactifs se réarrangent pour former de nouveaux noyaux.
Conséquence importante: lors d’une transformation nucléaire il n’y a pas conservation des éléments chimiques.
Bien que les éléments ne se conservent pas les transformations nucléaires obéissent cependant à certaines règles de conservation.
Règle de conservation des transformations nucléaires:
- Le nombre total de nucléons se conserve (il y a le même total de nucléons dans les produits et les réactifs)
- La charge électrique totale se conserve (il y a la même nombre de charges électriques élémentaires pour les réactifs et les produits).
Remarque
Les transformations nucléaires ne respectent également pas la conservation de la masse.
Equation de transformation nucléaire
Tout comme une transformation chimique ou physique une transformation nucléaire peut être représentée de manière symbolique par une équation de réaction nucléaire.
Cette équation reprend certains codes déjà utilisés:
- Les réactifs sont notés à gauche séparés d’un signe “+”
- Les produits sont notés à droite séparés d’un signe “+”
- Une flèche sépare les réactifs des produits
Il y a cependant aussi quelques différences entre une équation de réaction chimique et une équation de réaction nucléaire:
- Les formules chimiques (des réactifs et des produits) sont remplacées par les symboles des noyaux et des particules libres.
- L’équation de réaction nucléaire respecte les règles de conservation propres aux transformations nucléaires.
Une équation de réaction nucléaire aura donc une écriture du type:
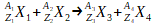
La conservation du nombre total de nucléons au cours de cette transformation se traduit par la relation suivante entre les nombres de masse:
A1 + A2 = A3 + A4
La conservation de la charge totale de cette transformation se traduit par la relation suivante:
Z1 + Z2 = Z3 + Z4
Exemple
La réaction nucléaire entre un noyau d’uranium 235 et d’un neutron forme un noyau de brome 87, un noyau de lanthane 146 ainsi que des neutrons. Cette transformation nucléaire peut être représentée par l’équation de réaction nucléaire suivante:
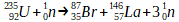
Fission nucléaire
Définition
Une fission nucléaire est une transformation nucléaire au cours de laquelle un noyau forme plusieurs (au moins deux) noyaux comportant moins de nucléons que lui.
Une fission nucléaire ne peut se produire qu’avec des “gros” noyaux, c’est à dire des noyaux comportant un nombre élevé de nucléons (souvent plus d’une centaine) qui se fragmentent sous l’effet d’une collision avec une particule (souvent neutron).
Pour vérifier qu’une transformation nucléaire est une fission il suffit de vérifier qui tous les noyaux formés ont chacun moins de nucléons que le noyau initial.
Exemple
Sous l’effet d’une collision avec un neutron, un noyau de plutonium 239 se fragmente en un noyau de Tellure 135 et un noyau de molybdène 102 tout en libérant 3 neutrons.
Cette fission nucléaire peut être décrite par l’équation de réaction suivante:
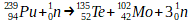
On reconnait bien ici une réaction de fission:
- L’un des réactifs est un “gros” noyau de plutonium qui comporte plus de 200 nucléons.
- Le deuxième réactif est un neutron qui va provoquer l’éclatement du “gros” noyau.
- Deux des produits sont des noyaux plus “petits” que le plutonium.
- Cette transformation produit aussi 3 neutrons qui peuvent à leur tour provoquer d’autres fissions.
Fusion nucléaire
Définition
Un fusion nucléaire est une transformation nucléaire au cours de laquelle deux noyaux s’unissent pour former un noyau de taille plus importante.
Une fusion nucléaire ne peut avoir lieu que pour des “petits” noyaux, c’est à dire des noyaux comportant très peu de nucléons (en général quelques nucléons) comme l’hydrogène, l’hélium, le béryllium.
La fusion ne peut se produire qu’à température très élevée, lorsque les noyaux ont assez d’énergie pour se rapprocher et vaincre les forces de répulsion électrostatique qui tendent à les éloigner (parce qu’ils portent tous les deux des charges positives) . Lorsque l’énergie des noyaux est suffisante alors ils peuvent se rapprocher suffisamment et “fusionner”, c’est à dire former un noyau plus “gros” comportant davantage de nucléons que les noyaux de départ.
Exemple
Un noyau d’hydrogène 2 et un noyau d’hydrogène 3 peuvent fusionner pour former un noyau d’hélium 4. Cette fusion peut être décrite par l’équation de réaction suivante:
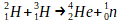
Cette transformation est bien une fusion car l’hélium formé est constitué de 4 nucléons, ce qui est davantage que chacun des réactifs (2 nucléons pour l’hydrogène 2 et 3 pour l’hydrogène 3)
Energie libérée par les transformations nucléaires
Les transformations nucléaires sont toutes des transformations exothermiques
Toutes les transformations nucléaires libèrent de l’énergie en des proportions qui sont nettement supérieures à celles des transformations physiques ou chimiques.
Les réactions de fission nucléaire sont exploitées pour produire de l’énergie électrique au sein des centrales nucléaires (la plupart exploitent la fission de l’uranium 235).
Les réactions de fusion nucléaire ne sont pas encore maîtrisées et ne sont pas exploitées pour produire de l’énergie électrique mais elles se réalisent naturellement au coeur du Soleil et des autres étoiles.
Lors de son cycle principal d’existence une étoile est le siège de fusion nucléaire entre des isotopes de l’hydrogène et de l’hélium mais à la fin de sa vie, et notamment lors des supernova, des éléments plus lourds fusionnent progressivement pour donner naissance à des noyaux atomiques encore plus lourds. L’énergie libérée lors des fusions nucléaires stellaires est convertie en énergie de rayonnement. ( Pour en savoir plus sur la “nucléosynthèse stellaire” vous pouvez voir le cours première enseignement scientifique “Niveau d’organisation: les éléments chimiques”
L’énergie libérée lors des transformations nucléaires est liée à une forme particulière d’énergie associée à la masse. Lors d’une transformation nucléaire le nombre total de nucléons se conserve mais pas la masse totale: une partie de la masse est convertie en énergie.
Les autres cours de physique-chimie niveau seconde
- Corps purs et mélanges au quotidien
- Les solutions aqueuses, un exemple de mélange
- Du macroscopique au microscopique, de l’espèce chimique à l’entité
- Le noyau de l’atome, siège de sa masse et de son identité
- Le cortège électronique de l’atome définit ses propriétés chimiques
- Vers des entités plus stables chimiquement
- Transformation physique
- Transformation chimique
- Transformation nucléaire
- Décrire un mouvement
- Modéliser une action sur un système
- Principe d’inertie
- Emission et perception d’un son
- Vision et image
- Circuits électriques
- Capteurs