Cours de physique-chimie | première spécialité
Ce cours correspond à la partie “Structure des entités organiques” du programme de première spécialité.
Il est situé dans la partie du programme “Constitution et transformations de la matière – Propriétés physico-chimiques, synthèses et combustions d’espèces chimiques organiques”
- Qu’est-ce qu’une espèce chimique organique ?
- Exemples d’espèces chimiques organiques
- Les espèces chimiques non organiques
- Formules développées et semi-développées
- Groupes caractéristiques
- Familles chimiques
- Les alcanes
- Les alcools
- Les cétones
- Les aldéhydes
- Les acides carboxyliques
Nommer les molécules organiques
- La nomenclature des espèces organiques
- Structure du nom d’une molécule organique
- Chaîne principale d’une molécule organique: définition
- Repérer la chaîne principale d’un alcane ramifié
- Repérer la chaîne principale d’une molécule portant un groupe caractéristique
- Préfixe de la chaîne principale
- Numéroter les carbones d’une chaîne principale
- Trouver le nom des substituants alkyles
- Indiquer la liste des substituants alkyles
- Suffixe des molécules organiques
- Méthode générale pour nommer une molécule organique
- Nommer une molécule organique à partir de sa formule semi-développée – exemple n°1
- Nommer une molécule organique à partir de sa formule semi-développée – exemple n°2
- Nommer une molécule organique à partir de sa formule semi-développée – exemple n°3
- Trouver la formule semi-développée d’une espèce organique à partir de son nom – exemple n°1
- Trouver la formule semi-développée d’une espèce organique à partir de son nom – exemple n°2
- Trouver la formule semi-développée d’une espèce organique à partir de son nom – exemple n°3
Identifier une espèce chimique grâce à la spectroscopie infrarouge
- Le nombre d’onde
- La transmittance
- Principe de la spectroscopie infrarouge
- Les spectres infrarouges
- Bandes d’absorption des groupes caractéristiques
- Trouver la famille d’une molécule grâce à son spectre infrarouge
REVISER – AUTRES COURS DE PREMIERE SPECIALITE – APPROFONDIR ET DECOUVRIR
Les espèces organiques
Qu’est-ce qu’une espèce chimique organique ?
À l’origine la famille des composés organiques regroupait les espèces chimiques produites spécifiquement par des organismes vivants (plantes, animaux, micro-organismes, insectes…) mais cette définition a évolué et n’est plus d’actualité. Il est vrai que les composés organiques peuvent être produits par des être vivants mais il existe d’autres voies pour les obtenir.
Définition
Une espèce chimique est dite organique si elle est composée essentiellement de carbone et d’hydrogène.
Une espèce chimique peut aussi comporter d’autres atomes (le plus souvent de l’oxygène, de l’azote, du soufre, du chlore) qui constituent des groupes caractéristiques.
La structure principale d’une molécule organique est constituée par un enchaînement d’atomes de carbone que l’on appelle “squelette carboné” de la molécule.
Exemples d’espèces chimiques organiques
- Le méthane
Sa formule est CH4 , bien qu’il n’ait qu’un seul carbone et pas une vraie chaîne carbonée, il fait partie de la famille des alcanes qui sont des composés organiques.
- L’éthane
Sa formule semi-développée est CH3-CH3 , il s’agit d’un autre membre de la famille des alcanes (comme le méthane).
Son squelette carboné est constitué de l’enchaînement de deux atomes de carbone et il ne porte que des atomes d’hydrogène.
- L’éthanol
Sa formule semi-développée est CH3-CH2-OH, c’est un membre de la famille des alcools dont le squelette carboné ne comporte que deux atomes de carbone (comme l’éthane).
- L’octane
Sa formule semi-développée est CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 , c’est un autre membre de la famille des alcanes dont le squelette carboné est un enchaînement linéaire de hui atomes de carbone.
- Le 2-methylbutane
Sa formule semi-développée est:
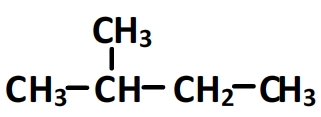
C’est aussi un alcane, il a un squelette carboné constitué d’une chaîne ramifiée (non linéaire) de 5 carbone.
- Le cyclohexane
Sa formule semi-développée est:
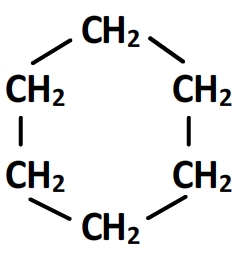
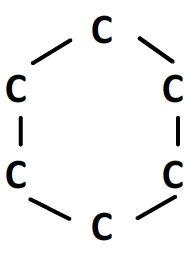
C’est un alcane cyclique aussi appelé cycloalcane dont le squelette carboné comporte un cycle (une boucle), c’est à dire un enchaînement de carbone refermé sur lui-même.
Son squelette carboné est donc:
Les espèces chimiques non organiques
Si une espèce chimique n’est pas organique alors elle est qualifiée d’inorganique ou de minérale
Si une espèce chimique ne comporte aucun atome de carbone alors elle est nécessairement minérale.
Par exemple, l’eau (H2O), l’ammoniac (NH3), le dioxygène (O2), le diazote (N2), les métaux purs (fer, argent cobalt, cuivre…), les gaz nobles, sont des espèces chimiques minérales.
Si une espèce comporte du carbone mais pas d’hydrogène alors il y a de très grandes chances qu’elle soit minérale.
Par exemple, le graphite (carbone pur), le diamant (carbone pur), le dioxyde de carbone (CO2), le monoxyde de carbone (CO), les ions carbonates (CO32-) comportent du carbone mais pas d’hydrogène, ce sont des espèces chimiques minérales
Formules développées et semi-développées
Les formules développées et semi-développées sont les représentations les mieux adaptées aux molécules organiques, elles permettent de repérer facilement le squelette carboné, la chaîne principale, les éventuelles ramifications ainsi que les groupes caractéristiques.
Pour rappel:
La formule développée comporte les symboles atomiques de tous les atomes d’une molécule et représente toutes les liaisons covalentes entre ces atomes par des traits. Elle permet de connaître la composition d’une molécule (tout comme sa formule brute) ainsi que l’enchaînement des différents atomes au sein de la molécule.
Exemples de formules développées
- Le méthane
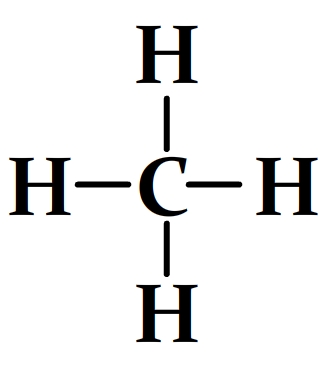
- L’éthanol
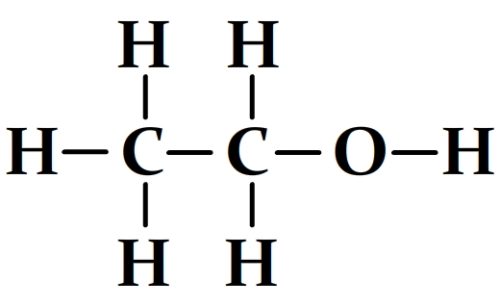
- L’acide propanoïque
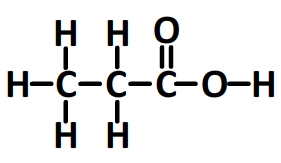
Par nature les espèces chimiques organiques comportent souvent un très grand nombre d’hydrogène qui “alourdissent” l’écriture des formules développées et on leur préfère souvent les formules semi-développées qui sont plus rapide à écrire et fournissent autant d’informations.
Dans une formule semi-développé les liaisons formées les atomes d’hydrogène ne sont plus représentées, les hydrogène sont noté à coté de l’atome qui les porte.
Exemples de formules semi-développées
- Le méthane
CH4
- L’éthanol
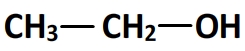
- L’acide propanoïque
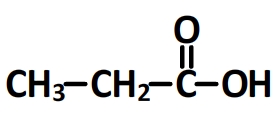
Groupes caractéristiques
Ils sont aussi appelés groupes fonctionnels.
Définition
Un groupe caractéristique est un groupe d’atomes liés entre eux qui comporte au moins un atome qui n’est ni du carbone ni de l’hydrogène.
Les espèces chimiques comportant le même groupe caractéristique appartiennent à la même famille chimique et présentent des propriétés chimiques comparables.
Seuls trois groupes sont à connaître en classe de première: le groupe hydroxyle, le groupe carbonyle et le groupe carboxyle.
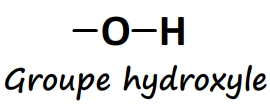
- Le groupe caractéristique hydroxyle
Il est constitué d’un oxygène lié à un hydrogène
- Le groupe caractéristique carbonyle
Il est constitué d’un oxygène formant une double liaison avec un carbone
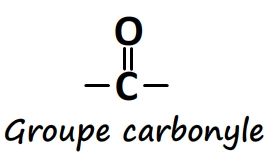
- Le groupe caractéristique carboxyle
L’association d’un groupe carbonyle et d’un groupe hydroxyle constitue un groupe carboxyle. Ce dernier est donc composé d’un oxygène formant une double liaison avec un carbone et ce même carbone forme aussi un liaison simple avec un autre oxygène qui lui même est lié à un hydrogène.
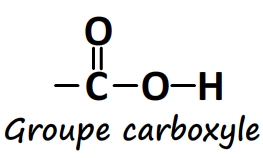
Familles chimiques
Une famille chimique regroupe l’ensemble des espèces chimiques possédant le même groupe caractéristique.
Les espèces chimiques d’une même famille présentent des propriétés chimiques proches.
En première il est nécessaire de connaître les familles suivantes:
- alcane
- alcool
- cétone
- aldéhyde
- acide carboxylique
Les alcanes
Les membres de cette famille sont des espèces chimiques constituées uniquement d’atomes de carbone et d’hydrogène et ne possédant que des liaisons simples (pas de doubles ou triples liaisons)
La terminaison du nom d’un alcane est toujours en “ane” (par exemple méthane, éthane, propane, butane, 2-méthyl-pentane….)
Les alcanes linéaires ont toujours une formule brute du type CnH2n+2 où n est un nombre entier.
D’après cette formule, si un alcane comporte un nombre “n” de carbones alors il possède aussi un nombre d’hydrogènes correspondant à deux fois ce nombre de carbones plus deux.
Cette formule générale résulte du fait qu’un atome de carbone forme toujours 4 liaisons et l’hydrogène un seul.
Une formule d’alcane sera par exemple:
- C1H4 pour n = 1
- C2H6 pour n = 2
- C3H8 pour n = 3
- C4H10 pour n = 4
- Etc
Un alcane cyclique aura une formule brute de type CnH2n
Alcane linéaire
Un alcane est dit linéaire si son squelette carboné est une chaîne, chaque carbone est lié au maximum à deux autres carbones.
Exemples d’alcanes linéaires
- Le propane : CH3-CH2-CH2-CH3
- Le pentane : CH3-CH2-CH2-CH2-CH3
- L’octane: CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3
Alcane ramifié
Un alcane est dit ramifié si son squelette carboné ne se réduit pas à une simple chaine. On distingue alors une chaîne centrale (dite chaîne principale) et des ramifications (appelées substituants ou groupements alkyles). Dans un alcane ramifié certains carbones peuvent réaliser trois voire quatre liaisons avec d’autres carbones.
Exemples d’alcanes ramifiés
- Le methylpropane
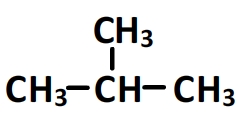
- Le 3,3-dimethyloctane
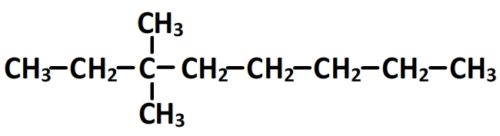
Alcane cyclique
Lorsqu’un alcane comprend un cycle (une boucle), c’est à dire un enchaînement de carbones qui se ferme sur lui même, alors on dit qu’il est cyclique.
Le préfixe “cyclo” est mentionné dans son nom (cyclopentane, cyclohexane) etc….
Exemples d’alcanes cycliques
- Cyclopentane
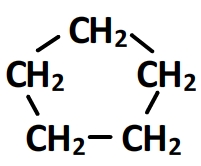
- Cyclohexane

Les alcools
Un alcool est une espèce chimique organique comportant un groupe caractéristique hydroxyle.
Si une espèces chimique appartient à la famille des alcools alors sa terminaison est en “ol” (par exemple méthanol, éthanol, propan-1-ol, butanol, 2-methylpentan-1-ol, ethan-1,2-diol….)
Un alcool linéaire a toujours une formule brute de la forme CnH2n+2O
Exemple d’alcools
- L’éthanol
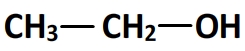
Une molécule d’éthanol est constituée d’une chaîne carbonée à deux carbones, l’un de ces deux carbones porte le groupe caractéristique hydroxyle.
- Le propan-1-ol
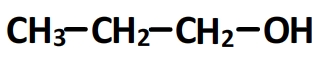
Il s’agit d’une molécule composée d’une chaîne à trois carbones et le groupe hydroxyle est porté par un carbone situé à l’une des extrémités de la chaine carbonée.
Les cétones
Une cétone est une espèce chimique caractérisée par la présence d’un groupe carbonyle qui n’est pas situé à l’une des extrémités de la chaîne carbonée.
Par conséquent le carbone du groupe carbonyle est lié à deux autres carbones du squelette carboné de la molécule.
Attention à ne pas confondre les cétones avec les aldéhydes qui possèdent aussi un groupe carbonyle mais celui-ci est en bout de chaîne carbonée.
Une espèce chimique de la famille des cétones possède toujours un nom qui se termine par “one” (par exemple la propanone, la butanone…)
Exemple de cétones
- Propanone
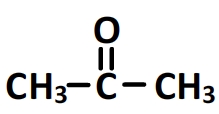
C’est une molécule à chaîne linéaire composée de trois atomes de carbone. Le carbone central de cette chaîne appartient au groupe carbonyle, il forme donc une double liaison avec un atome d’oxygène.
- Pentan-2-one
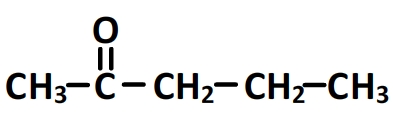
La pentan-2-one est aussi une molécule linéaire. La chaîne carbonée comporte 5 carbones et le deuxième carbone de la chaîne appartient au groupe carbonyle.
Les aldéhydes
Un aldéhyde est une espèce chimique comportant un groupe caractéristique carbonyle à l’une des extrémités de sa chaine carbonée.
Attention à ne pas confondre les aldéhydes avec les cétones qui possèdent aussi un groupe carbonyle (mais pas en bout de chaîne).
Le nom d’une espèce chimique faisant partie de la famille des aldéhydes se termine toujours par “al” (par exemple éthanal, propanal, butanal…)
Exemples d’aldéhydes
- L’ethanal
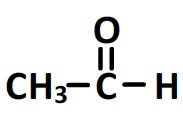
Il possède une chaine carbonée à deux carbones dont l’un est inclus dans un groupe carbonyle.
- Le butanal
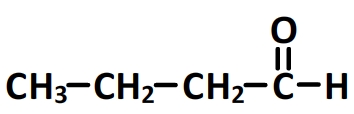
Il s’agit d’un aldéhyde linéaire à 4 carbones. L’un des deux carbones en bout de chaîne forme une double liaison avec un oxygène (et constitue avec ce dernier le groupe carbonyle).
Les acides carboxyliques
Un acide carboxylique est une espèce chimique caractérisée par la présence du groupe carboxyle toujours situé en bout de chaîne carbonée.
Le nom d’un acide carboxylique commence toujours par le terme “acide” et sa terminaison est en “oïque“. Par exemple, acide éthanoïque, acide propanoïque, acide butanoïque etc.
Exemples d’acide carboxyliques
L’acide éthanoïque
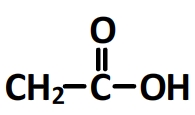
Aussi appelé acide acétique, il s’agit de l’acide présent dans le vinaigre. C’est une molécule organique dont la chaîne carbonée comporte seulement deux atomes. L’un des deux carbones fait partie du groupe carboxyle qui caractérise les acides carboxyliques.
L’acide butanoïque
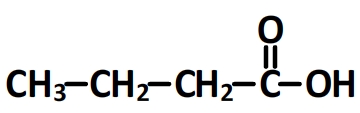
Aussi appelé acide butirique, il s’agit d’une molécule à chaîne linéaire de 4 carbones.
Nommer les molécules organiques
La nomenclature des espèces organiques
La nomenclature des espèces organiques est un ensemble de règles qui indiquent comment nommer une espèce organique à partir de sa structure (chaîne carbonée, ramifications, groupe caractéristique….)
Ces règles ont été établies par l’UICPA (l’Union Internationale de Chimie Pure et Appliquée), elles permettent de trouver le nom d’une espèce chimique à partir de sa formule développée ou inversement de trouver la formule développée d’une espèce chimique à partir de son nom.
Structure du nom d’une molécule organique
Le nom d’une molécule comporte deux parties qui sont:
- le préfixe des substituants et groupes fonctionnels secondaires (facultatif)
- la chaîne principale
Le nom de la chaîne principale est lui même formé deux parties:
- le préfixe
- le suffixe
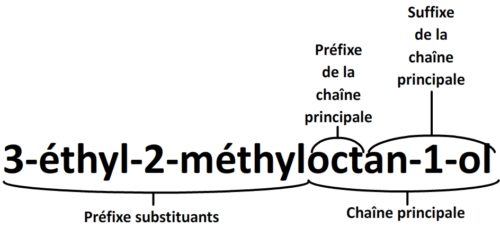
- Le préfixe des substituants et groupes fonctionnels secondaires
Il est noté à gauche, en premier dans le nom de la molécule.
Il indique la liste des “substituants” (c’est à dire des ramifications de la chaîne carbonée) ainsi que leur position sur la chaîne principale.
Il peut aussi comporter la liste et la position des groupes fonctionnels secondaires lorsqu’une molécule comporte plusieurs groupes caractéristiques mais ce cas n’est pas rencontré en classe de première.
Remarque
Les molécules à chaîne carbonée linéaire ne possèdent pas de ramification et par conséquent leur nom ne comporte par de préfixe.
Exemples
– Dans le nom “2-méthylpentane” la partie “2-méthyl” correspond au prefixe, il indique que le carbone n°2 de la chaîne principale porte un substituant “méthyl.
– Dans le nom “3-éthyl-2,2-diméthyloctane” la partie “3-éthyl-2,2-diméthyl” correspond au prefixe, il indique que le carbone n°3 de la chaîne principale porte un substituant éthyle et le carbone n°2 porte deux substituants méthyl.
- Le préfixe de la chaîne principale
Le préfixe de la chaîne principale est formé à partir du nombre d’atomes de carbone qui constituent cette chaîne.
Exemples
-Dans le nom “2-méthylpentane” la partie “pent” correspond au préfixe de la chaîne principale, il indique qu’elle est constituée de cinq atomes de carbone.
-Dans le nom “3-éthyl-2,2-diméthyloctane” la partie “oct” correspond au préfixe de la chaîne principale qui comporte un total de huit atomes de carbone.
- Le suffixe de la chaîne principale
Il indique la présence ou l’absence de groupes caractéristiques ainsi que leur position dans la chaîne principale.
Exemples
-Dans le nom “2-methylpentane” le suffixe est “ane”, il indique que la molécule appartient à la famille des alcanes, elle ne comporte pas de groupe caractéristique ni de liaison multiple.
-Dans le nom “2-methyl-butan-1-ol”,le suffixe est “an-1-ol”, il indique que cette molécule appartient à la famille des alcools, son groupe caractéristique hydroxyle est porté par le premier carbone de la chaîne principale.
Chaîne principale d’une molécule organique: définition
Il s’agit de l’enchainement d’atomes de carbone constituant la “colonne vertébrale” du squelette carboné de la molécule, c’est la chaîne “centrale” qui porte ou inclut les groupes caractéristiques et les ramifications.
Elle est délimitée par les règles de nomenclature et le nombre de carbone qu’elle comporte définit le préfixe qui forme son nom.
Repérer la chaîne principale d’un alcane ramifié
En l’absence de groupe caractéristique, la chaîne principale correspond au plus long enchaînement de carbones que possède la molécule.
Exemple n°1
Une molécule possède la formule semi-développée suivante:
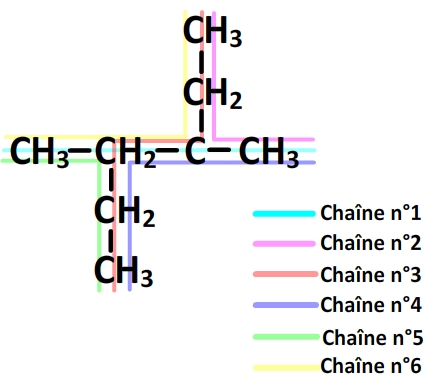
On peut repérer 6 chaînes différentes:
- La chaîne n°1 comporte 4 carbones
- La chaîne n°2 comporte 4 carbones
- La chaîne n°3 comporte 6 carbones
- La chaîne n°4 comporte 5 carbones
- La chaîne n°5 comporte 4 carbones
- La chaîne n°6 comporte 5 carbones
Par conséquent la chaîne principale est la chaîne n°3
Exemple n°2
Une molécule possède la formule semi-développée suivante:
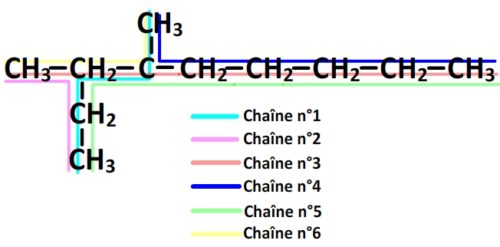
On peut repérer 6 chaînes possibles:
- La chaîne n°1 comporte 5 carbones
- La chaîne n°2 comporte 4 carbones
- La chaîne n°3 comporte 8 carbones
- La chaîne n°4 comporte 7 carbones
- La chaîne n°5 comporte 9 carbones
- La chaîne n°6 comporte 4 carbones
Par conséquent la chaîne principale est la chaîne n°5
Repérer la chaîne principale d’une molécule portant un groupe caractéristique
Lorsqu’une molécule organique possède un groupe caractéristique alors ce groupe, ou le carbone auquel il est lié, doit toujours faire partie de chaîne principale et dans ce cas là on définit la chaîne principale de la manière suivante:
La chaîne principale est le plus long enchaînement de carbones incluant le groupe caractéristique ou le carbone qui le porte.
Remarques
- Dans le cas d’un groupe caractéristique carbonyle ou carboxyle le carbone du groupe est inclus dans la chaîne principale.
- Dans le cas d’un groupe caractéristique hydroxyle alors le carbone qui porte ce groupe fait partie de la chaîne principale.
Exemples
Cette molécule appartient à la famille des alcools, sa chaîne principale inclut le carbone qui porte le groupe hydroxyle.
Préfixe de la chaîne principale
Le préfixe associé à une chaîne principale dépend du nombre d’atomes de carbone qu’elle comporte.
Exemples
- Le préfixe d’une chaîne principale comportant un seul carbone est “méth”
- Une chaîne principale avec deux atomes de carbone est associée au préfixe “éth”
En classe de première il est important de connaître par coeur au moins les dix premiers préfixes.
Liste des préfixes
| Nombre d’atomes de carbone dans la chaîne principale | Préfixe | Exemples |
| 1 | méth | méthane, méthanol |
| 2 | éth | éthane, éthanol, éthanal |
| 3 | prop | propane, propan-1-ol, propanal |
| 4 | but | butane, butan-2-ol, butan-2-one, 2-methylbutane |
| 5 | pent | pentane, pentan-1-ol, pentanal, penan-2-one, 3-methylpentan-1-ol |
| 6 | hex | hexane, hexan-3-ol, 2-ethylhexane, acide hexanoïque |
| 7 | hept | heptane, heptan-3-one, 3-ethylheptan-1-ol |
| 8 | oct | octane, 2,3-dimethyloctane, octanal |
| 9 | non | nonane, nonan-1,2-diol, acide nonanoïque |
| 10 | déc | décane, décan-4-ol, 4-propyldécane |
| 11 | undéc | undécane, undécan-3-ol, undécan-2-one |
| 12 | dodéc | dodécane, dodécan-4-ol, 3-ethyl-2methyl-dodécane |
Numéroter les carbones d’une chaîne principale
Il est nécessaire de numéroter les atomes de carbone qui constituent la chaîne principale afin de pouvoir indiquer la localisation des substituants liés à cette chaîne.
La numérotation débute toujours par l’une des extrémités:
le carbone n°1 est toujours situé à l’un des bouts de la chaîne principale.
Les autres carbones sont ensuite numérotés, dans l’ordre, à partir du carbone n°1:
- Le carbone de la chaîne principale lié au carbone n°1 correspond au n°2
- Le carbone de la chaîne principale lié au carbone n°2 correspond au n°3
- et ainsi de suite jusqu’au dernier carbone.
La question que l’on doit se poser avant de commencer à numéroter les carbones est:
quelle est l’extrémité de la chaîne principale qui comporte le carbone n°1 ?
Règle n°1:
Dans une molécule ramifiée mais ne comportant aucun groupe caractéristique le carbone n°1 est choisi de manière à obtenir les numéros les plus petits possibles pour indiquer la position des substituants.
Règle n°2:
Dans une molécule possédant un groupe caractéristique le carbone de ce groupe, ou le carbone de la chaîne principale liée à ce groupe, doit posséder le plus petit numéro possible.
En d’autres termes, le carbone n°1 de la chaîne principale est toujours celui qui est le plus proche du groupe caractéristique.
Trouver le nom des substituants alkyles
Le nom d’un substituant alkyle est formé d’un préfixe et d’un suffixe.
Les préfixes utilisés pour les substituants alkyles sont les mêmes que ceux de la chaîne principale:
- méth pour une chaîne alkyle à un carbone
- éth pour une chaîne alkyle à deux carbones
- etc
Le suffixe d’un alkyle est toujours “yle” mais lorsqu’il figure en tant que substituant dans le nom d’une molécule organique on enlève le “e” final et son suffixe devient seulement “yl”.
Voici la liste des alkyles linéaires possédant jusqu’à huit carbones (mais en pratique il est rare que les alkyles recontrés en classe de première possèdent plus de quatre carbones)
| Nombre de carbones | Nom du groupement alkyle |
| 1 | Méthyle |
| 2 | éthyle |
| 3 | propyle |
| 4 | butyle |
| 5 | pentyle |
| 6 | hexyle |
| 7 | heptyle |
| 8 | octyle |
Exemples
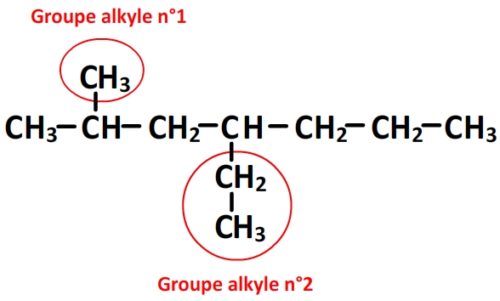
Indiquer la liste des substituants alkyles
La liste des substituants alkyles forme le préfixe du nom de la molécule organique.
Dans cette liste le nom des substituants est indiqué sans le “e” final:
- méthyle devient méthyl
- éthyle devient éthyl
- propyle deviengt propyl
etc…
Le nom du substituant est précédé du numéro du carbone de la chaîne principale par lequel il est porté.
Le numéro et le nom de l’alkyle sont séparés par un tiret “-“
Exemples
- un substituant méthyle porté par le carbone n°3 est noté 3-méthyl
- un substituant éthyle porté par le carbone n°4 est noté 4-éthyl
S’il y a plusieurs alkyles alors leurs noms sont indiqués les uns à la suite des autres (avec leur position) en les séparant par un tiret “-“.
Les noms des alkyles sont notés dans l’ordre alphabétique (sans tenir compte des “di” ou “tri”).
Exemples
- on note 3-éthyl-2-méthyl (et non 2-méthyl-3éthyl) car le substituant “éthyl” est avant le substituant “méthyl” dans l’ordre alphabétique.
- on note 5-butyl-2-methyl-3-propyl
Si le même substituant alkyle est présent plusieurs fois dans une même molécule alors:
- on ajoute un préfixe devant le nom de l’alkyle pour préciser s’il est présent deux fois (di), trois fois (tri) ou quatre fois (tétra)….
- les différentes positions du groupement alkyle sont indiquées sous forme de liste où les numéros sont séparés d’une virgule.
Exemples
- si une molécule possède un substituant méthyle en position n°2 et un autre en position n°3 alors on note 2,3-diméthyl
- si une molécule possède un premier substituant méthyle en position n°2, un deuxième en position n°3 et un troisième en position n°4 alors on note 2,3,4-triméthyl
- Si une molécule possède deux groupements éthyle en position n°4 alors on note 4,4-diéthyl
Suffixe des molécules organiques
- Les alcanes
Le suffixe d’un alcane est toujours “ane”
Exemples
- méthane
- éthane
- propane
- 2-méthylbutane
- Les alcools
Le suffixe d’un alcool est “anol” mais on insère entre la partie “an” et “ol” le numéro du carbone qui porte le groupe hydroxyle (ce numéro est situé entre deux tirets)
Exemples
- propan-1-ol
- propan-2-ol
- butan-1-ol
- pentan-3-ol
- Les cétones
Le suffixe d’une cétone est “anone” mais on insère le numéro du carbone du groupe carbonyle entre la partie “an” et la partie “one”.
Remarque
Le carbone du groupe carbonyle d’une cétone ne sera jamais en position “1” (sinon il ne s’agirait plus d’une cétone mais d’un aldéhyde!)
Exemples
- Propan-2-one
- butan-2-one
- pentan-3-one
- hexan-2-one
- Les aldéhydes
Le suffixe d’un aldéhyde est toujours “anal”.
On ne précise pas la position du groupe carbonyle car dans un aldéhyde ce dernier est toujours en bout de chaîne carbonée et son carbone est donc toujours le n°1.
Exemples
- éthanal
- propanal
- butanal
- pentanal
- Les acides carboxyliques
Le suffixe d’un acide carboxylique est “anoïque”
On ajoute le mot “acide” en premier
La position du groupe carboxylique n’est pas précisée puisqu’il est nécessairement en position n°1
Exemples
- acide éthanoïque
- acide propanoïque
- acide butanoïque
- acide pentanoïque
Méthode générale pour nommer une molécule organique
Etape n°1: vérifier si la molécule possède un groupe caractéristique
Etape n°2: repérer la chaîne principale de la molécule
(voir paragraphes “Repérer la chaîne principale d’un alcane ramifié” et “Repérer la chaîne principale d’une molécule portant un groupe caractéristique“)
- Si la molécule n’a pas de groupe caractéristique alors elle correspond au plus long enchaînement de carbones.
- Si la molécule comporte un groupe caractéristique alors elle correspond au plus long enchaînement de carbones incluant ou portant ce groupe.
Etape n°3: numéroter la chaîne principale
(voir paragraphe “Numéroter les carbones d’une chaîne principale“)
- Si la molécule comporte un groupe caractéristique alors le premier carbone de la chaîne est situé à l’extrémité la plus proche de ce groupe.
- Si la molécule ne comporte pas de groupe caractéristique alors on choisit le carbone de l’extrémité qui permet d’obtenir les plus petits numéros pour la position des substituants alkyles.
Etape n°4: former le nom de la chaîne principale
(voir paragraphes “Préfixe de la chaîne principale” et “Suffixe des molécules organiques“)
- Le préfixe est formé en fonction du nombre de carbones dans la chaîne principale (méth, éth, prop…)
- Le suffixe dépend du groupe caractéristique et de sa position dans la chaîne principale)
Etape n°5: Etablir la liste des substituants alkyles et repérer leur position de manière à former la première partie du nom de la molécule.
(voir paragraphes “Trouver le nom des substituants alkyles” et “Indiquer la liste des substituants alkyles“)
Nommer une molécule organique à partir de sa formule semi-développée – exemple n°1
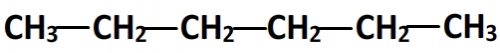
- Cette molécule n’a pas de groupe caractéristique par conséquent elle appartient à la famille des alcanes: le suffixe de la chaîne principale est “ane”
- Cette molécule ne comporte pas de ramifications par conséquent sa seule et unique chaîne de carbones correspond à la chaîne principale.
- Etant donné l’absence de substituant et de groupe caractéristique il est inutile de numéroter la chaîne principale.
- Puisque la chaîne principale comporte six carbones (préfixe “hex”) et que cette molécule est un alcane (suffixe “ane”) alors la chaîne principale a pour nom “hexane”
- Il n’y a pas de substituant.
- Puisqu’il n’y a pas de substituant, le nom complet de cette molécule est aussi “hexane“.
Nommer une molécule organique à partir de sa formule semi-développée – exemple n°2
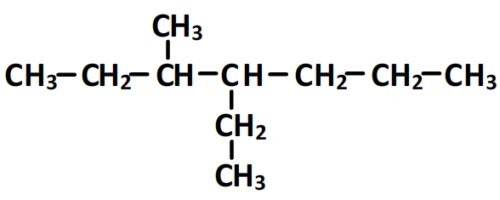
- Cette molécule n’a pas de groupe caractéristique par conséquent elle appartient à la famille des alcanes: le suffixe de la chaîne principale est “ane”
- La chaîne principale comporte 6 carbones:
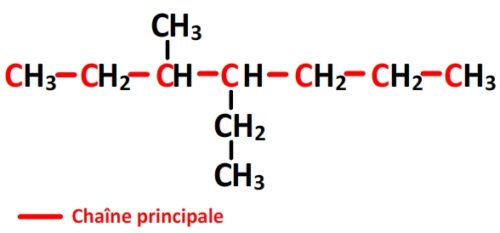
- La chaîne principale porte deux substituants différents, le carbone n°1 est celui qui permet de leur attribuer les numéros “3” et “4” aux substituants ( Si l’autre carbone était le numéro “1” alors les substituants seraient en position “4” et “5”).
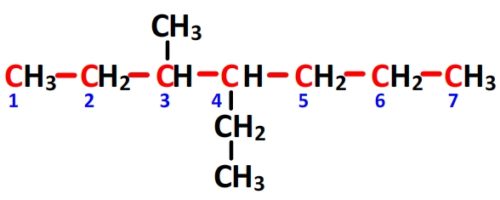
- Puisque la chaîne principale comporte sept carbones (préfixe “hept”) et que cette molécule est un alcane (suffixe “ane”) alors la chaîne principale a pour nom “heptane”
- Il y a un substituant à 2 carbones lié au carbone n°4 de la chaîne principale qui sera donc appelé “4-éthyl”, il y a aussi un substituant à un 1 carbone lié au carbone n°3 de la chaîne principale qui se nomme “3-méthyl”. Le préfixe des substituants sera donc 4-éthyl-3méthyl.
- Le nom de complet de cette molécule est donc “4-éthyl-3méthylheptane“.
Nommer une molécule organique à partir de sa formule semi-développée – exemple n°3
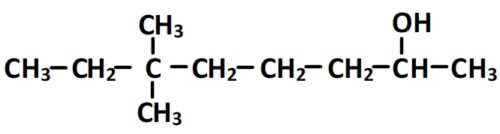
- Cette molécule comporte un groupe hydroxyle par conséquent elle appartient à la famille des alcools et possède un suffixe du type an-“position”-ol.
- La chaîne principale comporte 8 carbones
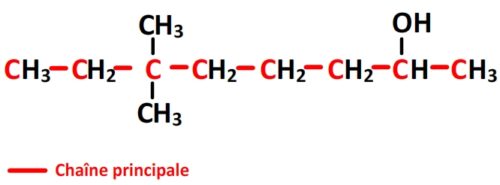
- La chaîne principale porte un groupe caractéristique hydroxyle qui est prioritaire sur les substituants alkyles. Le carbone n°1 est donc le plus proche du groupe hydroxyle.
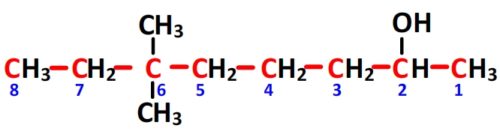
- Puisque la chaîne principale comporte huit carbones (préfixe “oct”) et que cette molécule est un alcool dont l’hydroxyle est en position n°2, la chaîne principale se nomme donc “octan-2-ol”
- Il y a deux substituants alkyles composés chacun d’un carbone (méthyl) tous les deux portés par le carbone n°6 de la chaîne principale. Le préfixe des substituants est donc “6,6-diméthyl”
- Le nom de complet de cette molécule est donc “6,6-diméthyloctan-2-ol“.
Trouver la formule semi-développée d’une espèce organique à partir de son nom – exemple n°1
Nom de la molécule: Propan-1-ol
La préfixe de la chaîne principale est “prop” par conséquent la chaîne principale comporte 3 atomes de carbone.
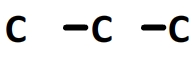
Il n’y a pas de substituant alkyle sur cette chaîne car le nom de la chaîne principale n’est pas précédé d’un préfixe.
Le suffixe en “an-1-ol” indique la présence d’un groupe hydroxyle porté par le premier carbone de la chaîne principale:
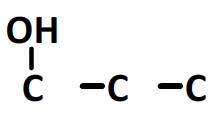
La formule semi-développée complète est obtenu en ajoutant les hydrogènes porté par chaque carbone de manière à arriver à un total de 4 liaisons par carbone:
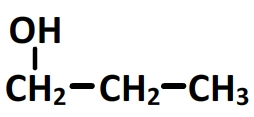
Trouver la formule semi-développée d’une espèce organique à partir de son nom – exemple n°2
Nom de la molécule: Acide 2-methylpropanoïque
Le préfixe de la chaîne principale est “prop”, par conséquent la chaîne principale comporte 3 carbones:
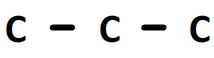
Le suffixe “anoïque” de la chaîne principale indique la présence d’un groupe carboxyle en bout de chaîne dont le carbone est en position n°”1″:
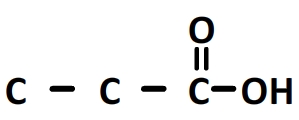
Le préfixe “3-méthyl” indique que le carbone n°2 de la chaîne principale porte un substituant alkyle méthyl à 1 carbone:
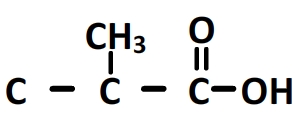
La formule semi-développée complète est obtenue en ajoutant les hydrogènes manquant:
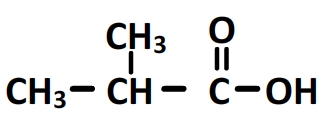
Trouver la formule semi-développée d’une espèce organique à partir de son nom – exemple n°3
Nom: 2-ethyl-2,3-dimethylpentanal
Le préfixe de la chaîne principale est “pent” donc la chaîne principale comporte 5 carbones:
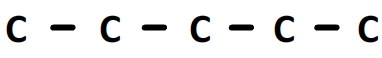
Le suffixe de la chaîne principale est en “anal” par conséquent le carbone numéro “1” de cette chaîne fait partie d’un groupe carbonyle:
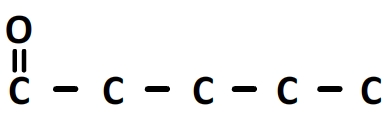
Le préfixe ” 2-ethyl-2,3-dimethyl” indique qu’il y a un substituant éthyle porté par le carbone n°2, un substituant méthyl porté par le carbone n°2 et un deuxième substituant méthyl porté par le carbone n°3:
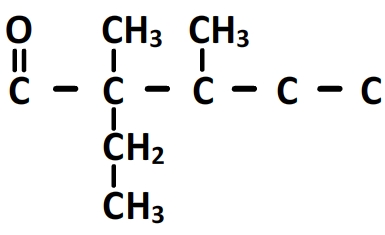
La formule semi-développée s’obtient en ajoutant les hydrogènes manquant:
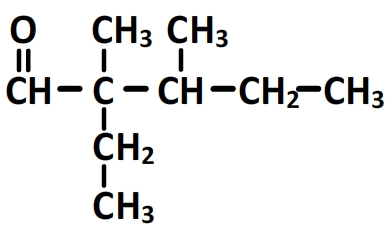
Identifier une espèce chimique grâce à la spectroscopie infrarouge
Le nombre d’onde
Le nombre d’onde est une grandeur notée “σ” (lettre grecque sigma minuscule) qui s’exprime en cm-1 (centimètre moins un)
Tout comme la longueur d’onde ou la fréquence c’est une grandeur qui permet de distinguer les différents rayonnements.
Le nombre d’onde peut être calculé à partir de la longueur d’onde grâce à la relation suivante:
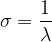
où:
- σ est le nombre d’onde (en cm-1)
- λ est la longueur d’onde (en cm)
Attention, l’unité de la longueur d’onde n’est pas l’unité standard (le mètre) mais le centimètre, il ne faut donc pas oublier de la convertir avant d’utiliser cette relation.
Par exemple, pour une une longueur d’onde de 900,00 nm:
λ = 900,00 nm
λ = 900,00.10-9 m
λ = 9,0000.10-7 m
λ = 9,0000.10-7.102 cm
λ = 9,0000.10-5 cm
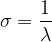
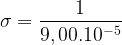
σ = 11111 cm-1
La transmittance
La transmittance est une grandeur notée en général “T” qui n’a pas d’unité.
Elle s’exprime le plus souvent sous forme d’un pourcentage (compris entre 0 et 100%) mais elle est aussi parfois exprimée sous forme fractionnaire (dont la valeur est comprise entre 0 et 1).
Si un échantillon de matière est éclairé par un rayonnement et qu’une partie de ce rayonnement traverse l’échantillon de matière alors:
- Le rayonnement qui éclaire la matière est appelé “rayonnement incident”
- Le rayonnement qui traverse l’échantillon de matière et en émerge est appelé “rayonnement transmis”
- L’échantillon de matière peut absorber ou réfléchir une partie (ou parfois la totalité) du rayonnement incident.
La transmittance traduit la proportion de rayonnement transmis par rapport au rayonnement incident.
Plus précisément la transmittance correspond au pourcentage de l’intensité du rayonnement transmis par rapport au rayonnement incident:
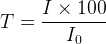
où:
- I0 est l’intensité du rayonnement incident
- I est l’intensité du rayonnement transmis (exprimé dans la même intensité que I0)
- T est la transmittance exprimée en pourcentage
La transmittance (tout comme l’absorbance) dépend:
- de la longueur d’onde du rayonnement
- des dimensions de l’échantillon de matière traversé par le rayonnement
- de la nature de l’échantillon de matière
- de la concentration du soluté lorsque l’échantillon de matière est une solution aqueuse.
La valeur de la transmittance est comprise entre 0 et 100 % avec:
- Si T = 0% alors aucun rayonnement n’est transmis (la totalité du rayonnement incident est absorbé ou réfléchi), le milieu est dit “opaque” au rayonnement.
- Si T = 100% alors la totalité du rayonnement est transmis, le milieu est “transparent” pour ce rayonnement.
Principe de la spectroscopie infrarouge
Les molécules organiques sont le siège de différents types de vibrations qui impliquent leurs liaisons covalentes: on distiguent les vibrations d’élongation et les vibrations de déformation.
Les vibrations d’élongation correspondent à des variations périodiques de la distance qui séparent deux atomes liés, ils se rapprochent puis s’éloignent, se rapprochent de nouveau puis s’éloignent etc.
Une vibration de déformation fait intervenir des variations périodiques d’angles entre deux liaisons covalentes: ces angles connaissent une succession de diminutions et d’augmentations.
Lorsqu’une molécule organique est exposée à un rayonnement infrarouge celui-ci peut être absorbé et accroître l’amplitude des vibrations:
Une molécule peut absorber certains rayonnements infrarouges
La longueur d’onde des rayonnements infrarouges absorbés par une molécule organique dépend:
- de la nature des atomes liés
- de la multiplicité des liaisons formées (simple, double ou triple)
- des atomes présents dans le “voisinage immédiat” des liaisons
En analysant les longueurs d’ondes des rayonnements infrarouges absorbés par une molécule organique on peut mettre en évidence et identifier les différents groupes caractéristiques qu’elle comporte.
Les spectres infrarouges
- Comment obtenir un spectre infrarouge ?
Un spectre infrarouge peut être obtenu grâce à un appareil appelé spectrophotomètre: l’espèce chimique à analyser y est exposée à des rayonnements infrarouges dont le nombre d’onde varie en général de 200 cm-1 à 4000 cm-1.
La mesure de la transmittance sur cet intervalle de nombre d’onde permet d’obtenir un graphique qui constitue le spectre infrarouge de l’espèce chimique.
XXXX photo scpectrophotomètre
XXXX illustration rayonnement incident cuve
- Abscisses et ordonnées d’un spectre infrarouge
Un spectre infrarouge représente les variations de la transmittance en fonction du nombre d’onde:
-La transmittance est indiquée en ordonnées, l’axe est gradué de 0 à 100 (si la transmittance est exprimée sous forme de pourcentage) ou de 0 à 1 (si la transmittance est exprimée sous forme fractionnaire).
– Le nombre d’onde (en cm-1) est indiqué en abscisses de manière décroissante sur un intervalle allant de 200 cm-1 à 4000 cm-1.
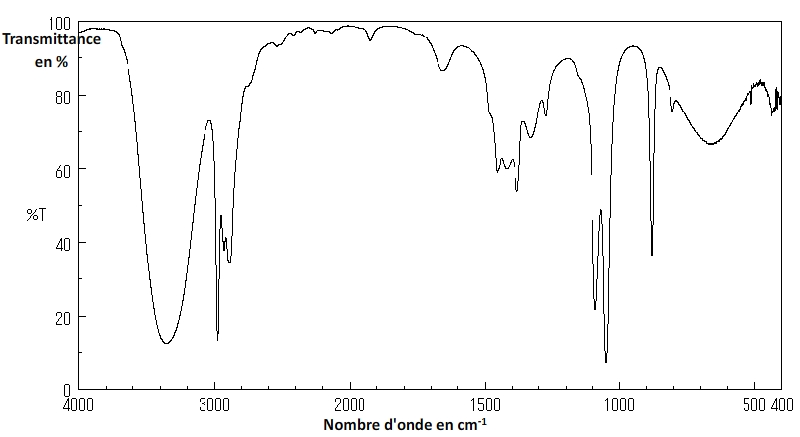
- Pics et bandes d’un spectre infrarouge
Sur un spectre infrarouge l’absence d’absorption se traduit par des zones “hautes” où la transmittance est proche de 100% tandis que les absorptions correspondent à des creux plus où moins profonds et larges qui constituent des pics et des bandes.
Bandes d’absorption des groupes caractéristiques
Chaque type de liaison d’une molécule organique absorbe les infrarouges dans un intervalle de longueurs d’ondes qui la caractérise.
L’analyse des pics et bandes d’absorption présents ou absents sur un spectre infrarouge permet d’identifier les groupes caractéristiques que possède une molécule organique.
Il n’est pas exigé de connaître les intervalles de longueurs d’absorption des différentes liaisons mais ils faut être capable de les exploiter lorsqu’ils sont fournis en données. (néanmoins l’interprétation d’un spectre IR est tout de même plus facile et rapide si l’on sait repérer les pics propre à chaque groupe!)
Seule la zone du spectre où le nombre d’onde est supérieur à 1500 cm-1 (partie gauche du spectre) est exploitée pour identifier les groupes caractéristiques. La zone où le nombre d’onde est inférieur à 1500 cm-1 est appelée “empreinte digitale” de l’espèce chimique, elle est propre à chaque espèce chimique et ne permet pas de repérer des groupes caractéristiques.
Voici les principales bandes d’absorption qui peuvent être utilisées pour identifier les groupes caractéristiques au programme de première spécialité:
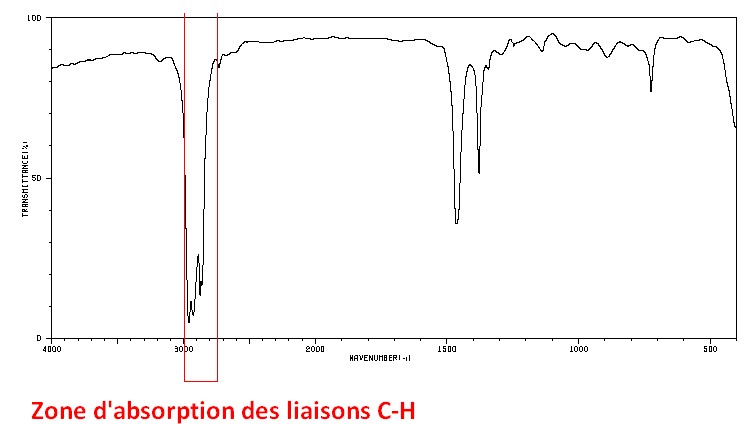
C–H
- Liaison carbone – hydrogène
- Les autres liaisons du carbone ne se font qu’avec des carbones ou des hydrogènes)
- Nombre d’onde σ : de 2850 cm–1 à 3000 cm–1
- Largeur de la bande: Variable (le plus souvent moyenne)
- Intensité de la bande: Moyenne à forte
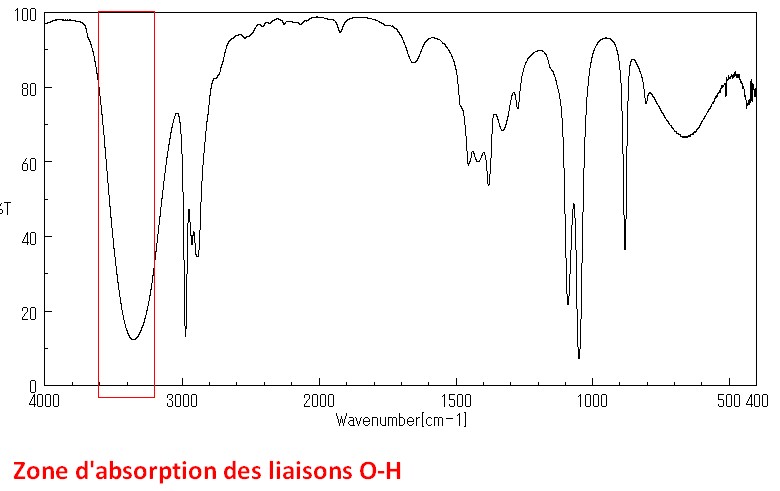
O–H lié
- Liaison oxygène-hydrogène
- Groupe hydroxyle pour une espèce chimique en solution aqueuse concentrée ou sous forme de corps pur et en l’absence d’autres groupes caractéristiques portés par le même carbone que O-H.
- Nombre d’onde σ: de 3200 en cm–1 à 3600 en cm–1
- Largeur de la bande: Large
- Intensité de la bande: Forte
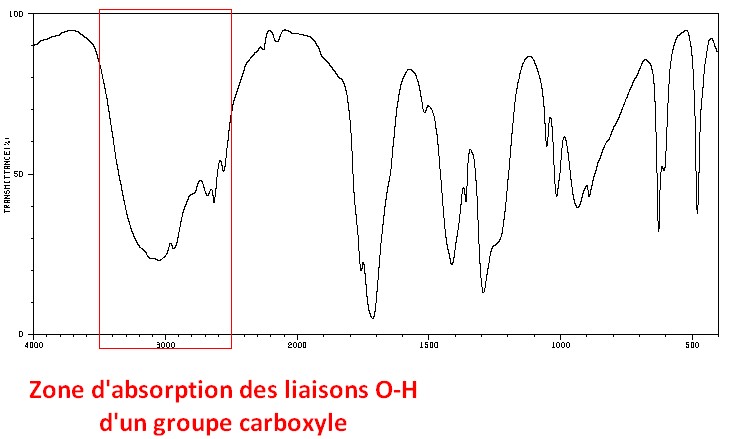
O–H groupe carboxyle
- Liaison oxygène-hydrogène
- Groupe hydroxyle appartenant à un groupe carboxyle.
- Nombre d’onde σ: de 2 500 cm–1 à 3 500 cm–1
- Largeur de la bande: Large
- Intensité de la bande: moyenne à forte
C=O cétone
- Double liaison carbone – oxygène
- Groupe carbonyle d’une fonction chimique cétone (le carbone n’est pas en bout de chaîne, il n’est lié ni à un hydrogène ni à un oxygène)
- Nombre d’onde σ: Vers 1715 cm–1
- Largeur de la bande: Fine
- Intensité de la bande: Forte
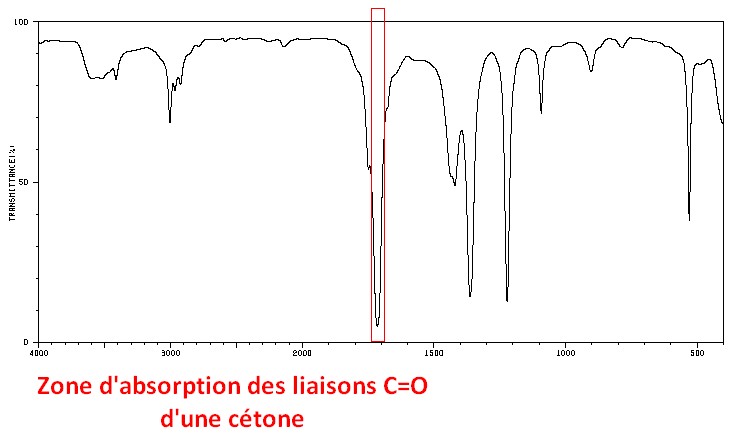
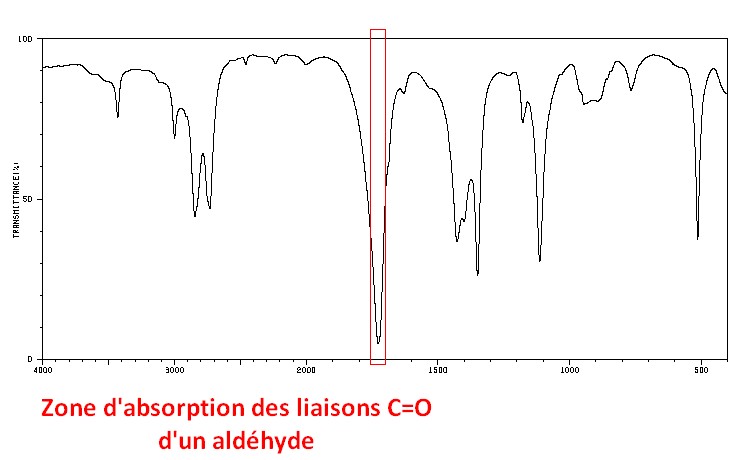
C=O aldéhyde
- Double liaison carbone – oxygène
- Groupe carbonyle d’une fonction chimique aldéhyde (le carbone du groupe est en bout de chaîne carboné, il est lié à un hydrogène)
- Nombre d’onde σ: vers 1715 cm–1
- Largeur de la bande: Fine
- Intensité de la bande: Forte
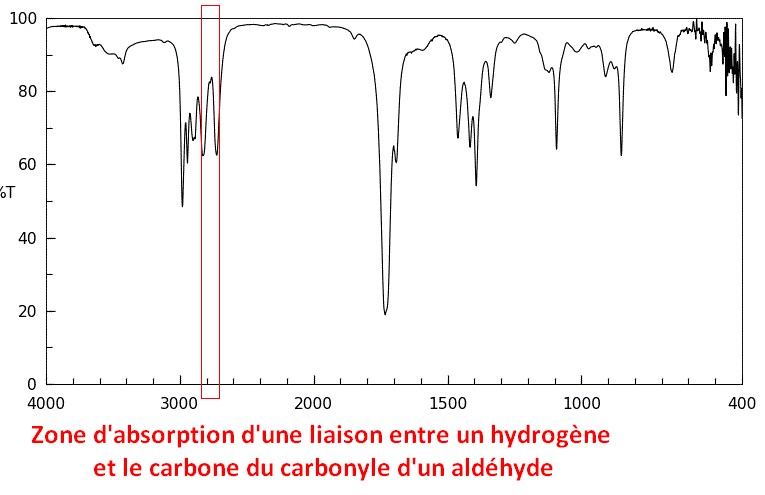
H-C=O aldéhyde
- Liaison hydrogène-carbone
- Hydrogène lié au groupe carbonyle d’une fonction aldéhyde.
- Nombre d’onde σ: de 2700 à 2830 cm–1 (Double pic)
- Largeur de la bande: Fine
- Intensité de la bande: Faible à moyenne
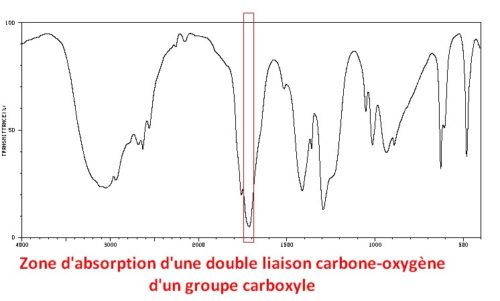
C=O acide carboxylique
- Double liaison carbone-oxygène
- Groupe carbonyle faisant partie d’un groupe carboxyle
- Nombre d’onde σ: vers 1715 en cm–1
- Largeur de la bande: Fine
- Intensité de la bande: Forte
Trouver la famille d’une molécule grâce à son spectre infrarouge
Identifier un alclane
- Pour identifier un alcane il faut vérifier qu’au delà de 1500 cm-1 le spectre ne comporte qu’une seule bande d’absorption entre 2850 cm-1 et 3000 cm-1 (qui caractérise les liaisons C-H )
Identifier un alcool
- Vérifier la présence d’une bande d’absorption caractéristique de la liaison O-H du groupe hydroxyle située entre 3200 et 3600 cm-1.
- S’assurer que cet hydroxyle ne fait pas partie d’un groupe carboxyle en vérifiant l’absence d’une bande d’absorption vers 1715 cm-1 caractérisant la liaison C=O d’un carbonyle.
Identifier une cétone
- Vérifier la présence d’une bande d’absoption fine et intense vers 1715 cm-1 caractéristique d’une liaison C=O.
- S’assurer que le groupement carbonyle n’est pas celui d’un aldéhyde en vérifiant l’absence d’un double pic d’absorption vers 2700 – 2850 cm-1 caractérisant la liaison entre le carbone d’un carbonyle et un hydrogène.
- S’assurer que le groupement carbonyle n’est pas celui d’un acide carboxylique en vérifiant l’absence d’une bande d’absorption large entre 2500 et 3500 cm-1 caratéristique de la liaison O-H d’un groupe carboxyle.
Identifier un aldéhyde
- Vérifier la présence d’une bande d’absoption fine et intense vers 1715 cm-1 caractéristique d’une liaison C=O.
- Vérifier la présence d’un double pic d’absorption vers 2700 – 2850 cm-1 caractérisant la liaison entre le carbone d’un carbonyle et un hydrogène.
Identifier un acide carboxylique
- Vérifier la présence d’une bande d’absorption fine et intense vers 1715 cm-1 caractéristique d’une liaison C=O.
- Vérifier la présence d’une bande d’absorption large entre 2500 et 3500 cm-1 caractéristique de la liaison O-H d’un groupe carboxyle.
A réviser
Cours de seconde:
Les autres cours de première spécialité
- Quantité de matière, masse molaire et concentration
- Réaction d’oxydoréduction et avancement
- Titrage colorimétrique redox
- Schéma de Lewis, géométrie, électronégativité et polarisation
- Cohésion des solides, dissolution, solubilité, hydrophilie et lipophilie
- Structure et nomenclature des espèces organiques
- Synthèse organique
Pour approfondir et découvrir
- Introduction à la nomenclature organique – Le Mans université
- Spectral Database for Organic Compounds SDBS – Base de données sur les espèces organiques incluant des spectres infrarouges
