Cours de chimie niveau seconde – Constitution et transformations de la matière – Partie 1: de l’échelle macroscopique à l’échelle microscopique – B) Modélisation de la matière à l’échelle microscopique – Vers des entités plus stables chimiquement.
- Définition
- Ecrire la formule de Lewis d’une molécule
- Formule de Lewis de molécules simples courantes
- Ecrire la formule de Lewis d’un atome
- Formule de Lewis et géométrie des molécules
- Formule de Lewis et réactivité chimique
Définition
La formule de Lewis (nom donné en hommage au chimiste américain Gilbert Lewis ….) d’une molécule est une représentation sur laquelle figurent tous les doublets d’électrons, qu’ils soient liants ou non liants. Par conséquent elle diffère peu d’une formule développée qui comporte déjà les liaisons (doublets liants), et sur laquelle il suffit d’ajouter les doublets non liants pour qu’elle devienne une formule de Lewis.
Ecrire la formule de Lewis d’une molécule
Pour écrire la formule de Lewis d’une molécule il suffit :
- d’écrire la formule développée de cette molécule
- d’ajouter autour de chaque symbole atomique les doublets non liants
Pour ajouter les doublets non liants on peut choisir l’une ou l’autre des méthodes suivantes :
- exploiter la connaissance du nombre de doublets non liants associé à chaque élément chimique (l’hydrogène et le carbone n’en n’ont pas, l’oxygène en a toujours deux, l’azote deux, les halogènes trois etc).
- exploiter les règles de stabilité chimique (sauf pour l’hydrogène) qui implique que le nombre total de doublets (liants et non liants) doit être de quatre. Ainsi un atome formant une seule liaison (un seul doublet liant) doit être entouré de 4-1 = 3 doublets non liants, un atome avec deux liaisons doit comporter deux doublets non liants, un atome avec trois liaisons en a un seul et un atome formant quatre liaisons n’a aucun doublet non liant.
Exemple
La molécule d’éthanol, de formule brute C2H6O a la formule développée suivante
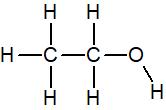
Les carbones et hydrogènes n’ont pas de doublet non liant mais l’oxygène en a deux par conséquent sa formule de Lewis est :
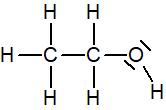
Formule de Lewis de molécules simples courantes
Eau
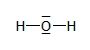
Dioxygène
![]()
Dioxyde de carbone
![]()
Diazote
![]()
Ammoniac
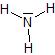
Acide acétique
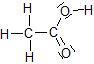
Chlorure d’hydrogène
![]()
Ecrire la formule de Lewis d’un atome
Il est également possible d’écrire la formule de Lewis d’un atome isolé (éventuellement dans le but de déterminer les possibles formules de Lewis correspondant à une formule brute), celui-ci est alors représenté par son symbole atomique entouré des doublets non liants (toujours symbolisés par des traits) mais les électrons non appariés (destinés à former une liaison covalente avec un autre atome) sont alors symbolisés par des points.
Exemples
Atome de carbone
![]()
Atome d’hydrogène
![]()
Atome d’oxygène
![]()
Atome d’azote
![]()
Formule de Lewis et géométrie des molécules
L’un des intérêts de la formule de Lewis est de permettre de prévoir la géométrie des molécules. En effet, cette dernière obéit à un principe relativement simple : tous les doublets (liants et non liants, simples ou multiples) se répartissent dans l’espace de manière à être éloignés au maximum les uns des autres en raison de la forces électriques répulsives qui s’exercent entre eux. Il est ainsi possible d’associer à chaque répartition de doublets autour d’un atome une géométrie (tétraédrique, pyramidale, plane etc)
Formule de Lewis et réactivité chimique
Les formules de Lewis présentent un intérêt particulier pour expliquer la réactivité chimique de certaines espèces et pour décrire les « mécanismes réactionnels» (les étapes intermédiaires d’une transformation chimique). En effet, les doublets liants correspondent à des zones de « concentration électronique » susceptibles de manifester une affinité pour les zones de « déficit électronique » ce qui permet d’expliquer la formation ou la rupture de liaisons entre certain groupements lors de la description d’un mécanisme réactionnel.
