Cours de chimie – Analyse chimique – lycée niveau classe de seconde – Partie constitution et transformations de la matière
- A quoi sert-il ?(son but)
- Comment le réaliser ?
- Transformation chimique exploitée par ce test
- Conclure à un test positif ou négatif
- Préparer de l’eau de chaux
Comme de nombreux gaz le dioxyde de carbone est incolore, un test chimique est indispensable pour le détecter. Le test du dioxyde de carbone est très souvent appelé « test à l’eau de chaux » en raison du réactif (l’eau de chaux) qu’on utilise pour le réaliser.
quoi sert-il ?(son but)
il permet de vérifier qu’un gaz est composé de dioxyde de carbone (CO2) pur ou contient du dioxyde de carbone (dioxyde de carbone mélangé à d’autres gaz).
On peut l’utiliser d’une manière générale:
- pour détecter du dioxyde dans un échantillon de gaz de nature inconnu
- pour analyser un dégagement gazeux
- pour tester la présence de dioxyde de carbone parmi les produits gazeux d’une transformation chimique
Et il est en particulier utilisé pour tester la présence de dioxyde de carbone dans :
- les gaz rejetés lors de la respiration humaine (il suffit de souffler avec une paille dans de l’eau de chaux).
- les produits de la combustion des composés organiques comme le papier, le gaz naturel, les hydrocarbures…
- les gaz libérés par les comprimés effervescents.
Remarque : si l’on fait brûler une espèce chimique et que l’on détecte du CO2 parmi ses produits alors on peut en conclure (par le biais du principe de conservation des éléments chimique) qu’elle contient du carbone et que cette espèce chimique est probablement d’un composé organique.
Comment le réaliser ?
Il faut dans un premier temps, comme dans tout test chimique, mettre en contact l’échantillon de matière à tester avec le réactif c’est à dire mettre en contact le gaz à tester avec l’eau de chaux. Pour cela, on peut opérer de deux manières possibles.

Avertissement : en raison des ions hydroxyde qu’elle contient l’eau de chaux est une solution très basique (son pH est proche de 12,5) ce qui la rend corrosive, irritante et toxique.


Il faut absolument ne pas en ingérer (même si elle contient du calcium!) et éviter tout contact d’une part avec la peau mais surtout avec les yeux. Pour l’utiliser les lunettes de protections sont indispensable ainsi que les gants et la blouse.
Méthode 1 :
- Recueillir le gaz à tester dans un récipient pouvant se fermer hermétiquement.
- Ajouter une petite quantité d’eau de chaux dans ce récipient puis refermer.
- Agiter et vérifier si l’eau de chaux se trouble.
Méthode 2 :
- Verser de l’eau de chaux dans une cuve ou un autre récipient.
- Faire barboter (faire bullez si vous préférez!) le gaz à tester dans cette eau de chaux.
- Faire dégager des bulles de gaz dans l’eau de chaux. Si le gaz à tester n’est pas issu d’un dégagement que l’on peut canaliser on peut faire un prélèvement à l’aide d’une seringue puis injecter dans l’eau de chaux.
- Vérifier si l’eau de chaux finit par se troubler.

Transformation chimique mise en jeu
L’eau de chaux utilisée pour le test du dioxyde de carbone est une solution aqueuse incolore saturée d’hydroxyde de calcium contenant des ions calcium Ca2+ et des ions hydroxyde.
Les ions hydroxyde font de l’eau de chaux une solution basique où le dioxyde de carbone CO2 forme des ions carbonate CO32-. Ces ions ont une solubilité qui dépend du cation auquel ils sont associés.
Cette solubilité est par exemple assez importante avec l’ion sodium mais elle est très faible avec l’ion calcium Ca2+. Par conséquent ces ions vont précipiter, c’est-à-dire former un solide, avec les ions calcium. Ce solide est du carbonate de calcium de formule CaCO3 de couleur blanche qui en se formant provoque le trouble de la solution.
Par conséquent le dioxyde de carbone qui se dissout dans l’eau de chaux forme dans un premier temps des ions carbonate :
CO2 + 2 OH– → CO32- + H2O
Puis dans un deuxième temps les ions carbonate précipitent :
CO32- + Ca2+ → CaCO3
On peut résumer ces transformations chimiques par une équation globale :
CO2 + (Ca2+ + 2 OH–) → CaCO3 + H2O
Conclure à un test positif ou négatif
Test positif :
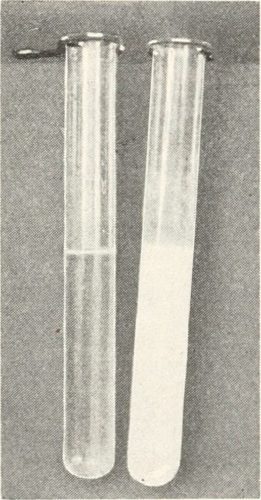
Le test est positif si l’eau de chaux se trouble c’est à dire qu’elle prend une couleur blanchâtre. On peut alors conclure que le gaz testé contient du dioxyde de carbone cependant on ne peut savoir si le dioxyde de carbone est pur ou s’il fait partie d’un mélange.
Test négatif :
Le test est négatif si l’eau de chaux garde son aspect limpide, le gaz n’est pas du dioxyde de carbone.
Remarque : si la quantité de dioxyde de carbone mélangé à l’eau de chaux est trop faible alors il est possible que l’eau de chaux ne se trouble pas. Par conséquent, en toute rigueur, si l’eau de chaux reste limpide on peut conclure soit à une absence totale de dioxyde de carbone dans le gaz testé soit à une proportion très faible. Par exemple l’air, qui ne contient que 0,04 % de dioxyde de carbone donne en apparence un résultat négatif.
Préparer de l’eau de chaux
S’il n’y a pas d’eau de chaux disponible il est possible de la préparer soi-même à partir de d’eau et de chaux (quelle surprise!).
Pour cela il suffit de :
- Mélanger environ une cuillère à soupe de chaux éteinte (hydroxyde de calcium) avec un litre d’eau distillée qui peut se fermer.
- Fermer le récipient et agiter.
- Laisser reposer et décanter un jour
- Filtrer et récupérer le filtrat, il s’agit d’une solution saturée d’hydroxyde de sodium qui constitue l’eau de chaux.
- L’eau de chaux doit ensuite être assez vite être mise dans des flacons hermétique (en la laissant à l’air libre on l’expose au dioxyde de carbone présent dans l’air qui se dissout progressivement et fini par former du carbonate de calcium)
Toute ces opérations sont évidemment à faire avec lunettes de protection, gants et blouse!
